دواء الدوبامين- من ويكيبيديا، الموسوعة الحرة
لمعانٍ أخرى، طالع دوبامين (توضيح).
دوبامين

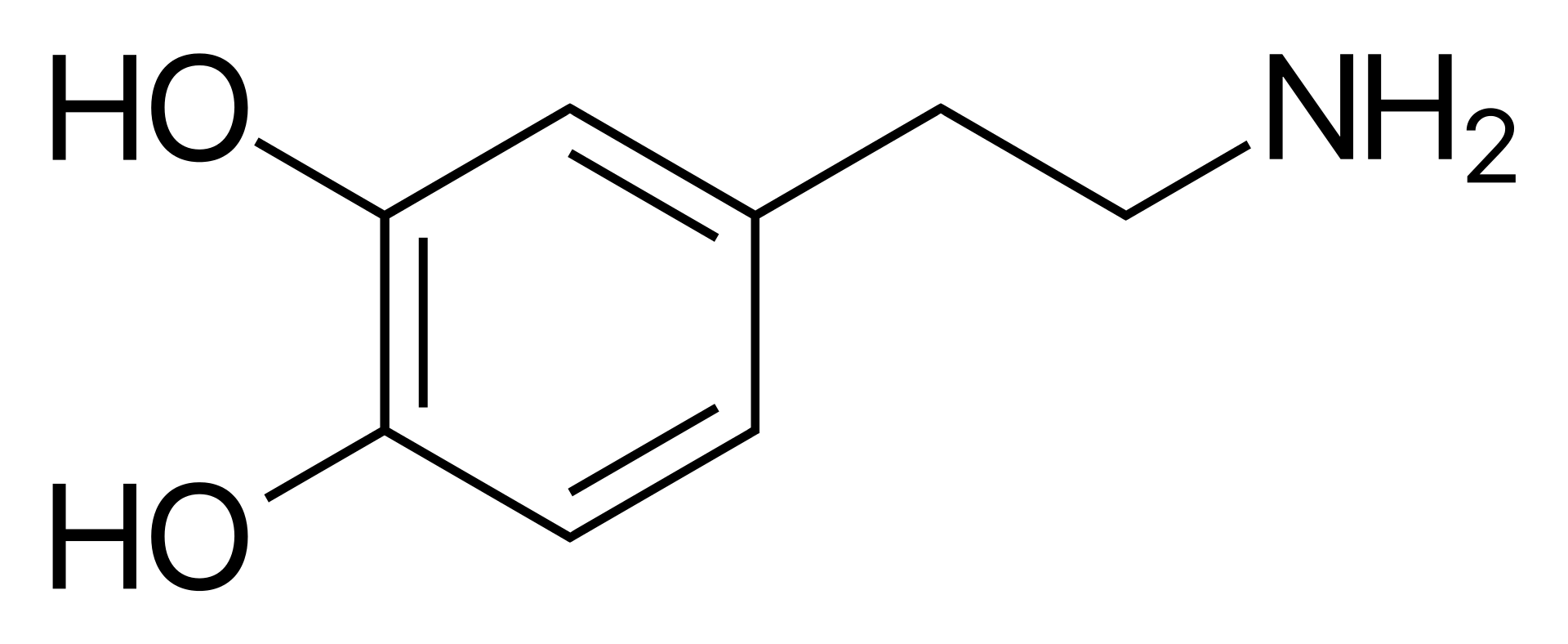
يعالج
اعتلال الكلية، وبطء القلب، وصدمة عصبية
اعتبارات علاجية
بيانات دوائية
استقلاب (أيض) الدواء MAO، COMT
بيانات فيزيولوجية
النسيج الحيوي المصدري المادة السوداء، المنطقة السقيفية البطنية، وغيرها
النسيج الحيوي المستهدف كامل الأجهزة
المستقبلات مستقبلات الدوبامين من الأنماط
D1، وD2، وD3، وD4، وD5، بالإضافة إلى المستقبلات المرتبطة بالأمين النزر 1
الناهضات بشكل مباشر: آبومورفين، بروموكريبتين
بشكل غير مباشر: كوكايين، أمفيتامين
المناهضات (الضادّات) مضادات الذهان، ميتوكلوبراميد، دومبيريدون
المركب الطليعي (السلف) فينيل ألانين، تيروسين، ليفودوبا (L-DOPA)
الاصطناع الحيوي نازعة كربوكسيل دوبا
الاستقلاب (الأيض) MAO، COMT
الدوبامين
مادّة عضوية تصنّف كيميائياً ضمن الكاتيكولامينات والفينئيثيلامينات. تُفرَز هذه المادّة في جسم الإنسان، وتلعب دور هرمون وناقل عصبي، ولها تأثيرات عديدة على الدماغ بشكلٍ خاصّ، وعلى جسم الإنسان بشكلٍ عامّ. يحتوي الدوبامين بنيوياً على مجموعة أمين، وهو يُصطنَع حيوياً من عملية نزع مجموعة كربوكسيل من سلفه المركّب الطليعي L-دوبا وذلك في الدماغ والكليتين. يُصطنَع هذا المركّب أيضاً في الكائنات الحيّة الأخرى مثل النباتات وأغلب الحيوانات. تقوم الخلايا العصبية في الدماغ بإفراز الدوبامين، وذلك ضمن مسارات دوبامينية عديدة ومميّزة، يلعب إحداها دوراً محورياً أساسياً في العامل التحفيزي في نظام المكافأة في الدماغ، إذ أنّ توقّع المكافآت يزيد من مستويات الدوبامين في الدماغ؛ ومن جهة أخرى، تقوم العقاقير نفسانية التأثير والمسبّبة للإدمان إمّا بزيادة إفراز الدوبامين أو بالعمل على حجب استرداد الخلايا العصبية لهذه المادّة بعد إفرازها. تساهم المسارات الدوبامينية -أيضاً- في التأثير على الجهاز الحركي، وفي التحكّم بإفراز هرمونات أخرى. تشكّل هذه المسارات مع مجموعةٍ خاصّة من العصبونات نظاماً محدّداً (نظام دوباميني) له القدرة على التعديل العصبي.
يُعرَف الدوبامين بين العوام وفي وسائل الإعلام المختلفة باسم «هرمون السعادة»؛ رغم أنّ دوره وفق علم الأدوية قائمٌ على إضفاء تميّز تحفيزي؛ بمعنى آخر، فإنّ الدوبامين يُفرَز عند إدراك بروز الأهمّية التحفيزية (مثل الرغبة) لنتيجةٍ معيّنة، ممّا يؤدّي إلى دفع سلوك الكائن الحيّ تجاه تحقيق تلك النتيجة.
يقوم الدوبامين خارج الجهاز العصبي المركزي بشكلٍ رئيسي في التأشير نظير الصمّاوي (أي أنّ له تأثير موضعي على إفراز الهرمونات الأخرى بالقرب من الغدد الصمّ حيث يُصطنَع بجوارها)؛ ففي الأوعية الدموية يقوم الدوبامين بتثبيط إفراز نورإبينفرين ويؤدّي دور موسّع وعائي (بتراكيز طبيعية)؛ وفي الكليتين يزيد من طرح الصوديوم والبول؛ وفي البنكرياس يقلّل من إنتاج الإنسولين؛ وفي الجهاز الهضمي يقلّل من قابلية الحركة في الأمعاء ويحمي الأغشية المخاطية فيها؛ وفي الجهاز المناعي يقلّل من نشاط الخلايا اللمفاوية.
يترافق نقص الدوبامين أو حدوث خلل في النظام الدوباميني مع حدوث عددٍ من أمراض الجهاز العصبي، كما أنّ هناك عددٌ من الأدوية المستخدمة في علاج تلك الأمراض والتي يقوم عملها على تغيير آثار الدوبامين. فعلى سبيل المثال، تحدث الإصابة بمرض باركنسون جرّاء فقدان الخلايا العصبية المفرزة للدوبامين في منطقة المادّة السوداء داخل الدماغ المتوسّط. لعلاج ذلك المرض تُستخدَم مادّة ليفودوبا، وهي المركّب الطليعي الذي يسبق الدوبامين في اصطناعه الحيوي داخل الجسم، وذلك ما يمكّن من تعويض العوز الحاصل. من الأمراض الأخرى المرتبطة بنقص نشاط الدوبامين كلّ من متلازمة تململ الساقين واضطراب نقص الانتباه مع فرط النشاط. من جهة أخرى، تشير دلائل على تغيّر مستويات نشاط الدوبامين في مرض الفصام؛ بحيث أنّ أغلب مضادّات الذهان المستخدمة في علاجه هي من مضادات الدوبامين، والتي تعمل على التقليل من نشاط هذه المادّة.
بشكلٍ
مشابه، تُستخدَم عقاقير مضادّة للدوبامين في مضادّات القيء. يُستخدَم الدوبامين
عقاراً بحدّ ذاته حيث يُعطى وريدياً؛ من جهة أخرى يمكن أن تكون العقاقير محاكية
الودّي الدوبامينية مسبّبة للإدمان عند أخذها بجرعات كبيرة.
البنيةيتألّف جزيء الدوبامين من بنية كاتيكول (وهي بدورها مؤلّفة من حلقة بنزينية مُستَبدلة بمجموعتي هيدروكسيل متجاورتين)، وهي مرتبطة بمجموعة أمينية عبر سلسلة من الإيثيل. بالتالي، فإنّ الدوبامين هو أبسط الكاتيكولامينات، وهي عائلة من المركّبات تتضمّن أيضاً كل من النواقل العصبية: نورإبينفرين وإبينفرين (أدرينالين). يؤدّي اتصال المجموعة الأمينية مع الحلقة البنزينية إلى تصنيف الدوبامين ضمن الفينيثيلامينات (مركّبات فينيثيلامين مستبدلة؛ تقرأ مجزأة على الشكل فين إيثيل أمين)، وهي مركّبات نفسانية التأثير.كما هو الحال مع أغلب الأمينات، فإنّ الدوبامين هو قاعدة عضوية؛
ولذلك فإنّه يسهل برتنة هذا المركّب في الأوساط الحمضية بتفاعل حمض-قاعدة نمطي. يتّسم الشكل المُبَرْتَن من الدوبامين بانحلاليته المرتفعة في الماء وباستقراره؛ ولكن يمكن أكسدته عند تعريضه للأكسجين أو لأحد المؤكسدات الأخرى. أمّا في الأوساط القاعدية، فلا يمكن برتنة الدوبامين؛ وفي شكل القاعدة الحرّة تلك يكون الدوبامين أقلّ انحلالية في الماء، كما يكون نشاطه الكيميائي كبيراً جداً. ولهذا السبب فإنّ الدوبامين غالباً ما يكون مثبّتاً على شكل ملح هيدروكلوريد، والذي يكون في حالته الجافّة على شكل مسحوق ناعم أبيض اللون.
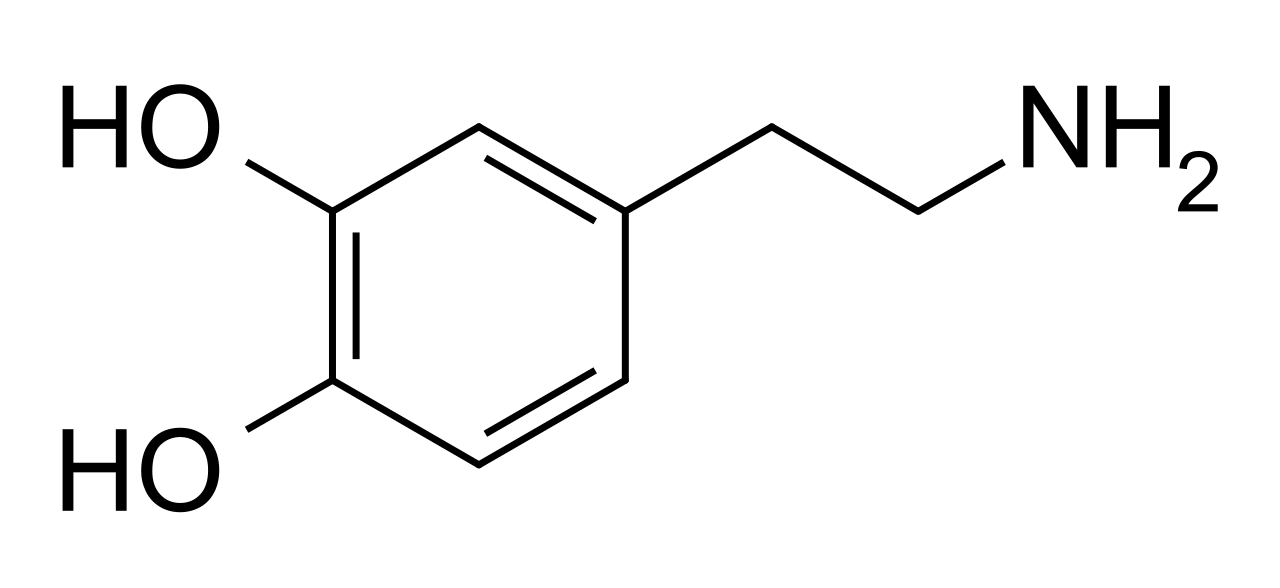
بنية الدوبامين
💥
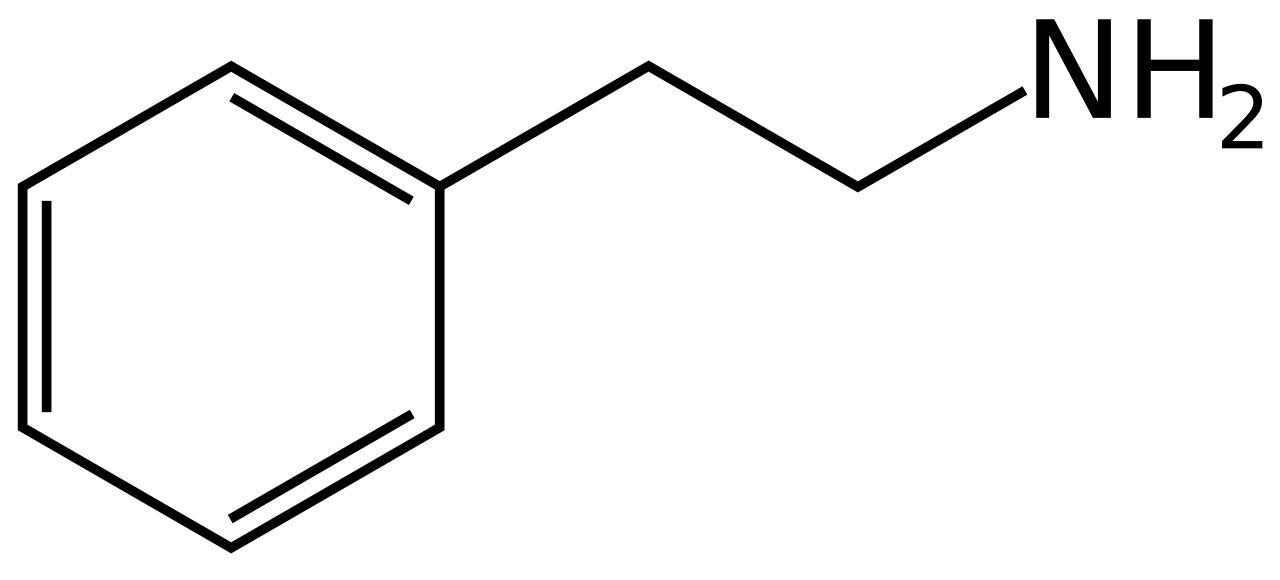
بنية الفينيثيلامين
💥

بنية الكاتيكول
الكيمياء الحيوية
مسار الاصطناع الحيوي لمركبات الكاتيكولامينات والأمينات النزرة في الدماغ البشري.
💥
L-فينيل ألانين
L-تيروسين
L-دوبا
أدرينالين
فينيثيلامين
p-تيرامين
دوبامين
نورإبينفرين
N-ميثيل فينيثيلامين
N-ميثيل تيرامين
p-أكتوبامين
سينفرين
3-ميثوكسي التيرامين
AADC
AADC
AADC
مسار
رئيسي
PNMT
PNMT
PNMT
PNMT
AAAH
AAAH
CYP2D6
مسار
ثانوي
COMT
DBH
DBH
تُشتَقّ مركّبات الكاتيكولامينات والأمينات النزرة من نمط الفينيثيلامين عند البشر من الحمض الأميني فينيل ألانين. يُنتَج الدوبامين نمطياً من L-تيروسين عبر L-دوبا؛ إلّا أنّ أدلّة جديدة بيّنت وجود CYP2D6 في الدماغ البشري، والذي يقوم بحفز الاصطناع الحيوي للدوبامين من L-تيروسين عبر p-تيرامين.
الاصطناع الحيوي
يُصطنَع الدوبامين حيوياً داخل جسم الإنسان وفق مساراتٍ محدّدة ومن نوعية محدّدة من الخلايا، وبشكلٍ أساسي من العصبونات والخلايا في لب الغدة الكظرية. هناك مسارٌ رئيسي للاصطناع ومسارَين ثانويّيَن: رئيسي: L-فينيل ألانين ← L-تيروسين ← L-دوبا ← دوبامين
ثانوي: L-فينيل ألانين ← L-تيروسين ← p-تيرامين ← دوبامين
ثانوي: L-فينيل ألانين ← m-تيروسين ← m-تيرامين ← دوبامينيُنتَج الدوبامين بشكل رئيسي من سلفه المركب الطليعي L-دوبا، والذي يمكن أن يُصطنَع بدروه بشكل غير مباشر من الحمض الأميني الضروري فينيل ألانين، أو بشكل مباشر من الحمض الأميني غير الضروري تيروسين. توجد هذه الأحماض الأمينية في تركيب أغلب البروتينات، وهي متوافرة في العديد من الأغذية. على الرغم من وجود الدوبامين نفسه في عددٍ من أنواع الطعام، إلّا أنّه عند امتصاصه يكون غير قادرٍ على عبور الحاجز الدموي الدماغي، الذي يحيط ويحمي الدماغ. لذلك ينبغي اصطناعه داخل الدماغ لتأمين نقله عصبياً.هناك عددٌ من الإنزيمات الضروري وجودها لتأمين اصطناع الدوبامين وفق المخطّط المرفَق. يُحوَّل L-فينيل ألانين إلى L-تيروسين بواسطة الإنزيم هيدروكسيلاز الفينيل ألانين (PAH)، والذي يُصنَّف ضمن إنزيمات هيدروكسيلاز الحمض الأميني العطري (AAAH)؛ ويقوم حينها الأكسجين الجزيئي (O2) ورباعي هيدرو البيوبتيرين (THB) بدور عامل مرافق. في خطوةٍ أخرى، يُحوَّل L-تيروسين إلى L-دوبا بواسطة الإنزيم هيدروكسيلاز التيروسين؛ ويقوم حينها رباعي هيدرو البيوبتيرين والأكسجين الجزيئي وأيونات الحديد الثنائي (2+Fe) بدور عاملٍ مرافق. بعد ذلك يُحوَّل L-دوبا إلى دوبامين بواسطة الإنزيم نازعة كربوكسيل L-الحمض الأميني العطري (AADC؛ والذي يُعرَف أيضاً باسم نازعة كربوكسيل دوبا)، حيث تقوم فوسفات البيريدوكسال بدور عامل مرافق.يُستخدَم الدوبامين نفسه مركباً طليعياً (مادّة بادئة) في اصطناع الناقِلَين العصبيَّين نورإبينفرين وإبينفرين (أدرينالين). يُحوَّل الدوبامين إلى نورإبينفرين بواسطة الإنزيم بيتا-هيدروكسيلاز الدوبامين (DBH)، ويقوم حينها الأكسجين الجزيئي O2 وحمض الأسكوربيك بدور العامل المرافق. وبدوره يمكن أن يُحوَّل مركّب نورإبينفرين إلى أدرينالين بواسطة الإنزيم ناقلة ميثيل-N فينيل إيثانولامين (PNMT) مع دخول S-أدينوسيل-L-ميثيونين عاملاً مرافقاً للإنزيم. أثناء عملية الاصطناع يكون من الضروري وجود كمّيات كافية من العوامل المرافقة، الأمر الذي يتطلّب اصطناعها؛ إذ أنّ النقص أو العوز في أحد الأحماض الأمينية أو العوامل المرافقة يمكن له أن يسبّب خللاً في اصطناع النواقل العصبية.
التكسير يُكسَّر الدوبامين إلى مستَقلَباته (نواتج عملية الأيض أو الاستقلاب) عبر مجموعة من الإنزيمات: أكسيداز أحادي الأمين (MAO) وناقلة ميثيل-O الكاتيكول (COMT) ونازعة هيدروجين الألدهيد (ALDH)، والتي تعمل على التوالي. يقوم كلا الشكلَين المتماثِلَين لأكسيداز أحادي الأمين MAO-A وMAO-B بتكسير الدوبامين بشكلٍ فعّال في الجسم. توجد عدّة مسارات مختلفة لتكسير الدوبامين، إلّا أنّ المُنتَج النهائي واحد، وهو حمض الهوموفانيليك (HVA)، والذي لا يمتلك أيّة فعّالية حيوية معروفة؛ وهو يُصفَّى من مجرى الدم بواسطة الكليتين ثم يُطرَح في البول.
إنّ المسارات الرئيسية لاستقلاب الدوبامين إلى حمض الهوموفانيليك تكون على الشكل: دوبامين ← دوبال (DOPAL) ← دوباك (DOPAC) ← حمض الهوموفانيليك (HVA) بواسطة الإنزيمات MAO وALDH وCOMT على الترتيب.
دوبامين ← 3-ميثوكسي تيرامين ← حمض الهوموفانيليك (HVA) بواسطة الإنزيمات COMT وMAO+ALDH على الترتيب.
استخدِمَت قياسات تركيز حمض الهوموفانيليك في بلازما الدم في بعض الدراسات على مرض الفصام من أجل تقدير مستويات فعّالية الدوبامين في الدماغ. إلّا أنّ صعوبةً واجهت هذا البحث، وهي ناجمةٌ عن المستويات المرتفعة من حمض الهوموفانيليك في البلازما والناتجة عن تكسير واستقلاب النورإبينفرين.على الرغم من أنّ الدوبامين يُكسَّر عادةً في الجسم عبر إنزيم أكسدة-اختزال (أكسيدوريدوكتاز)، إلّا أنّ المركّب عُرضةٌ أيضاً للأكسدة من التفاعل المباشر مع الأكسجين، الأمر الذي يعطي نواتجاً من كينونات بالإضافة إلى جذور حرّة؛ وهي مركّبات ذات سمية عصبية، وهناك دلائل أن تكسير الدوبامين وفق هذه الآليّة يمكن أن يساهم في فقدان العصبونات، وهو الأمر الذي يحدث في مرض باركنسون وغيره من الحالات العصبية الأخرى.
الوظائف
التأثيرات الخلوية
الأهداف الأساسية للدوبامين في الدماغ البشري.
العائلة المستقبل الجين النوع الآلية
مماثل لـD1 D1 DRD1 مقترن بـGs زيادة المستويات داخل الخلوية لـcAMP
عبر تنشيط محلِّقة الأدينيلات.
D5 DRD5
مماثل لـD2 D2 DRD2 مقترن بـGi تخفيض المستويات داخل الخلوية لـcAMP
عبر تثبيط محلِّقة الأدينيلات.
D3 DRD3
D4 DRD4
TAAR TAAR1 TAAR1 مقترن بـGs
مقترن بـGq زيادة المستويات داخل الخلوية لـcAMP
وتركيز الكالسيوم داخل الخلوي
مستقبلات الدوبامين وTAAR1
يمارس الدوبامين تأثيراته عبر الارتباط بالمستقبلات الغشائية وتنشيطها. للدوبامين لدى البشر ألفة ارتباط عالية مع مستقبلات الدوبامين والمستقبل المرتبط بالأمين النزر 1 البشري (hTAAR1). لدى الثدييات، تمّ تحديد خمسة أنواع فرعية من مستقبلات الدوبامين، وسُمّيت من D1 حتّى D5. وجميعها تعمل مستقبلات تحوّلية، وكمستقبلات مقترنة بالبروتين ج، أي أنّها تمارس تأثيراتها عبر نظام رسول ثانٍ معقّد. يمكن تقسيم هذه المستقبلات إلى عائلَتَين تعرفان باسم: مماثل لـD1 ومماثل لـD2. بالنسبة للمستقبلات المتواجدة على العصبونات في الجهاز العصبي، فالتأثير النهائي لتنشيط المستقبلات المماثلة لـD1 (وهي D1 وD5) يمكن أن يكون استثارةً (عبر فتح قنوات الصوديوم) أو تثبيطاً (عبر فتح قنوات البوتاسيوم)، أمّا التأثير النهائي لتنشيط المستقبلات المماثلة لـD2 (وهي D3 ،D2 وD4) هي عادةً تثبيط العصبون المستهدف. بناءً على ذلك، فمن الخطأ وصف الدوبامين في حدّ ذاته كمركّب استثاري أو تثبيطي: فتأثيره على العصبون المستهدف يعتمد على أنواع المستقبلات المتواجدة على غشاء ذلك العصبون وعلى الاستجابات الداخلية لذلك العصبون بالنسبة للرسول الثاني cAMP. مستقبلات D1 هي أكثر مستقبلات الدوبامين عدداً في الجهاز العصبي البشري، تليها مستقبلات D2، أمّا المستقبلات D4، D3 وD5 فهي متواجدة بأعداد منخفضة بشكل معتبَر.
التخزين
والتحرير والاسترداد
معالجة الدوبامين في المشبك. بعد تحرير الدوبامين يمكن إمّا استرداه مجدّداً بواسطة النهاية قبل المشبكية، أو تفكيكه بواسطة الإنزيمات.
TH: هيدروكسيلاز التيروسين
DOPA: ليفودوبا
DAT: ناقل الدوبامين
DDC: نازعة كربوكسيل دوبا
VMAT: ناقل أحادي الأمين الحويصلي 2
MAO: أكسيداز أحادي الأمين
COMT: ناقلة ميثيل-O الكاتيكول
HVA: حمض الهوموفانيليك
يعمل الدوبامين داخل الدماغ كناقل عصبي ومعدّل عصبي، ويتمّ التحكّم فيه عبر مجموعة من الآليات الشائعة عند جميع النواقل العصبية أحادية الأمين. بعد التخليق، يُنقَل الدوبامين من العصارة الخلوية في حويصلات مشبكية عبر ناقل مذاب، وهو الناقل أحادي الأميني الحويصلي VMAT2. يُخزَّن الدوبامين في هذه الحويصلات حتى يُطرَح في الشقّ المشبكي. في معظم الحالات، يحدث تحرير الدوبامين عبر عملية تسمّى الإيماس والتي تحدث بسبب جهود الفعل، لكن يمكن أن يحدث كذلك بسبب نشاط المستقبل المرتبط بأمين نزر،TAAR1. المستقبل TAAR1 ذو ألفة عالية للدوبامين وللأمينات النزرة ولبعض مستبدلات الأمفيتامين المتواجدة على طول الأغشية في الوسط داخل الخلوي الخاصّ بالعصبون قبل المشبكي؛ ويمكن أن يُعدِّل تنشيط المستقبل تأشيرَ الدوبامين عبر إحداث تثبيط استردادٍ للدوبامين ونقل عكسيٍ له وكذلك تثبيط النشاط العصبوني عبر آليات متنوّعة.عندما يبلغ الدوبامين المشبك يرتبط بمستقبلات الدوبامين وينشّطها. يمكن أن تكون هذه الأخيرة مستقبلات دوبامين بعد-مشبكية تتواجد في الزوائد الشجرية (للعصبون بعد المشبكي)، أو مستقبلات ذاتية قبل مشبكية (مثل مستقبلي: D2sh وD3 قبل المشبكيين) تتواجد على غشاء محور طرفي (العصبون قبل المشبكي). بعد أن يحصل العصبون بعد المشبكي على جهد فعل، تفكّ جزيئات الدوبامين بسرعة ارتباطها بالمستقبلات ويُعاد امتصاصها إلى العصبون قبل المشبكي عبر استردادٍ بواسطة ناقل الدوبامين أو ناقل أحادي الأمين الغشائي.
حين يعود الدوبامين إلى العصارة الخلوية، فهو إمّا أن يُفكَّك بواسطة أكسيداز أحادي الأمين أو يعاد شحنه في حويصلات بواسطة VMAT2 من أجل توفيره لإفرازات مستقبلية.
يتمّ التحكّم بمستوى الدوبامين خارج الخلوي في الدماغ عبر آليتين: انتقال طوري وتوتّري. يحدث تحرير (إفراز) الدوبامين الطوري -كما هو الحال عند تحرير معظم النواقل العصبية بالجهار العصبي- مباشرةً بواسطة جهود الفعل في العصبونات المحتوية على الدوبامين. ويحدث انتقال الدوبامين التوتّري حين تُحرَّر كمّيات صغيرة من الدوبامين من دون أن تسبقها جهود فعل قبل مشبكية. يُنظَّم الانتقال التوتري بواسطة عوامل متنوّعة منها: نشاط عصبونات أخرى واسترداد الناقل العصبي.
الجهاز العصبي
المقالة الرئيسة: مسارات دوبامينية
يلعب الدوبامين داخل الدماغ أدواراً مهمّة في الوظائف التنفيذية والتحكّم الحركي والتحفيز والتيَقُّط والتعزيز والمكافأة، وكذلك في الوظائف منخفضة المستوى مثل: إفراز الحليب والارتضاء الجنسي والغثيان. تشكّل المسارات ومجموعات الخلايا دوبامينية الفعل نظاماً دوبامينياً، وهو نظام تعديلي عصبي.
العصبونات دوبامينية الفعل (الخلايا العصبية المنتجة للدوبامين) قليلة العدد نسبياً (حوالي 400 ألف في الدماغ البشري،) وأجسامها الخلوية متجمِّعة في مجموعات بمناطق معدودة وصغيرة نسبياً في الدماغ. لكنّ محاورها تمتدّ إلى عدّة مناطق أخرى من الدماغ وتمارس تأثيرات قويّة على أهدافها. تمّت موضعة (تحديد موضع) هذه الخلايا دوبامينية الفعل لأوّل مرة سنة 1964 بواسطة أنيكا دالستروم وكجيل فوكس اللذان رمزا لها بحروف A (إشارة إلى aminergic أي أمينيّة الفعل أو منتجة للأمينات).
تحتوي المواقع من A1 حتى A7 في مخططهما على الناقل العصبي نورإبينفرين، بينما تحتوي المناطق A8 حتى A14 على الدوبامين. المناطق دوبامينية الفعل التي تم تحديدها هي: المادّة السوداء (المجموعتين 8 و9)، والمنطقة السقيفية البطنية (المجموعة 10)، وتحت المهاد الخلفي (المجموعة 11)، والنواة المقوّسة (مجموعة 12)، والمنطقة العائرة (المجموعة 13) والنواة المحيطة بالبطين (المجموعة 14). 💥

المسارات الرئيسية للدوبامين. كجزء من مسار المكافأة، يُخلَّق الدوبامين في أجسام عصبونية في المنطقة السقيفية البطنية ويُحرَّر في النواة المتكئة والقشرة أمام الجبهية. الوظائف الحركية للدوبامين مرتبطة بمسار آخر، مع أجسام عصبونية في المادّة السوداء التي تخلِّق وتُحرِّر الدوبامين في الجسم المخطّط.
المادّة السوداء هي منطقة صغيرة في الدماغ المتوسط وأحد مكوّنات العقد القاعدية، وتتكوّن من جزئين، منطقة إدخال تسمّى الجزء المكتنز، ومنطقة إخراج تسمّى الجزء الشبكي. تتواجد العصبونات دوبامينية الفعل بشكل أساسي في الجزء المكتنز (مجموعة الخلية A8) وبجوارها (المجموعة A9). تلعب العصبونات دوبامينة الفعل الممتدة من المادّة السوداء إلى الجسم المخطّط الظهري عبر المسار السوداوي المخطّطي دوراً معتبراً في وظيفة الحركة وفي تعلّم مهارات حركية جديدة لدى البشر. هذه العصبونات حسّاسة ومعرَّضة بشكلٍ خاصّ للتضرّر (التلف)، وينتج عن موت كمّية كبيرة منها متلازمة باركنسونية.المنطقة السقيفية البطنية (VTA) هي منطقة أخرى في الدماغ المتوسط، تمتدّ أبرز مجموعات عصبونات VTA دوبامينية الفعل إلى القشرة أمام الجبهية عبر المسار الوسطي القشري، كما تمتدّ مجموعة أخرى صغيرة إلى النواة المتكئة عبر المسار الوسطي الطرفي. يسمّى هذان المساران معاً باسم الامتداد الوسطي القشري الطرفي. ترسل الـVTA كذلك امتداداتٍ دوبامينية الفعل نحو اللوزة الدماغية والتلفيف الحزامي والحصين والبصلة الشمّية. تلعب العصبونات الوسط قشرية الطرفية دوراً في المكافأة وجوانب تحفيز أخرى.يملك تحت المهاد الخلفي عصبونات دوبامينية تمتدّ إلى الحبل الشوكي لكنّ وظيفتها غير معروفة جيّداً. توجد بعض الأدلّة على أنّ الاضطرابات في هذه المنطقة تلعب دوراً في متلازمة تململ الساقين، وهي حالة يعاني فيها المرضى من صعوبةٍ في النوم بسبب شعور قسري عارم لتحريك أجزاء الجسم باستمرار وخاصّة الساقين.تملك النواة المقوّسة والنواة المحيطة بالبطين في تحت المهاد عصبونات دوبامينية تشكّل امتداداً مهمّاً هو المسار الأحدوبي القمعي، الذي يمتدّ إلى الغدّة النخامية، حيث يؤثّر هناك على إفراز هرمون البرولاكتين. إنّ الدوبامين هو المثبّط العصبي الصمّاوي الأساسي لإفراز البرولاكتين من الغدّة النخامية الأمامية. يُفرَز الدوبامين المخلَّق بواسطة العصبونات في النواة المقوّسة داخل الجهاز النخامي البوابي الخاصّ بالبارزة الناصفة التي تزوّد الغدّة النخامية. الخلايا المفرزة للبرولاكتين وفي غياب الدوبامين تُفرز البرولاكتين باستمرار، ويقوم الدوبامين بتثبيط هذه العملية. في سياق تنظيم إفراز البرولاكتين، يسمّى الدوبامين عامل تثبيط البرولاكتين أو الهرمون المثبّط للبرولاكتين أو برولاكتوستاتين (مثبّط البرولاكتين).
تمتدّ المنطقة العائرة الواقعة بين النواة المقوّسة والنواة المحيطة بالبطين إلى عدّة مناطق من تحت المهاد وتشارك في التحكّم بالهرمون المطلق للغونادوتروبين الضروري لتنشيط نموّ الأجهزة التناسلية الذكرية والأنثوية.
تتواجد مجموعة إضافية من العصبونات دوبامينية الفعل في شبكية العين. هذه العصبونات هي خلايا أماكرين، ويعني ذلك أنّها لا تملك محوارات (محاور عصبية)، وتحرّر الدوبامين إلى الوسط خارج الخلوي وهي نشطة بشكل خاص خلال ساعات النهار وتصبح خامدة في الليل. يعمل هذا الدوبامين الشبكي على تحسين نشاط الخلايا المخروطية في الشبكية مع تثبيط الخلايا العصوية من أجل زيادة التحسّس للألوان والتباين في حالة الضوء الساطع، على حساب تحسّس منخفض حين يكون الضوء خافتاً.
العقد القاعدية

المسارات الرئيسية للعقد القاعدية. المسار دوباميني الفعل من الجزء المكتنز في المادّة السوداء إلى الجسم المخطّط موضَّحٌ باللون الأزرق الفاتح.
أكبر وأهمّ مصادر الدوبامين في الفقاريات هي المادّة السوداء والمنطقة السقيفية البطنية، ولهاتين البُنيتين صلة وثيقة ببعضهما ودور وظيفي متماثل في العديد من النواحي. فكلاهما مكوِّن من مكوّنات العقد القاعدية، وهي شبكة معقّدة من البُنى المتواجدة أساساً في قاعدة الدماغ الأمامي. أكبر مكوّن للعقد القاعدية هو الجسم المخطّط. ترسل المادة السوداء امتدادات دوبامينية الفعل إلى الجسم المخطّط الظهري، في حين ترسل المنطقة السقيفية البطنية امتداداً دوباميني الفعل من نوع مماثل إلى الجسم المخطّط البطني.إنّ التقدّم في فهم وظائف العقد القاعدية كان بطيئاً. تقترح أشهر الفرضيات -المصرّح بها على نطاق واسع- أنّ القعد القاعدية تلعب دوراً رئيسياً في اختيار الفعل. تقترح نظرية اختيار الفعل في أبسط هيئاتها أنّه حين يكون شخص أو حيوان في وضعية يجب عليه فيها القيام بفعل من عدّة أفعال ممكنة، يحدّد النشاط في العقد القاعدية أيّ فعل سيُنَفَّذ عبر تحرير ذلك الفعل من التثبيط مع الاستمرار في منع أنظمة الفعل الأخرى التي إنْ تمّ تنشيطها ستقوم بتوليد أفعال منافِسة. وعليه فالعقد القاعدية -في هذا المفهوم- مسؤولةٌ عن بدء التصرّفات والأفعال، ولكن ليس عن تفاصيل طريقة تنفيذها؛ بعبارةٍ أخرى، تشكّل العقد القاعدية نظام اتخاذ القرار.يمكن تقسيم العقد القاعدية إلى عدّة قطاعات، لكلّ واحدٍ منها دور في التحكّم بنوعٍ معيّن من الأفعال. تعمل القطاعات البطنية من العقد القاعدية (تحتوي على الجسم المخطّط البطني والمنطقة السقيفية البطنية) على أعلى مستوى في الهرمية، وتختار الأفعال على مستوى الكائن بأكمله.
أمّا القطاعات الظهرية (تحتوي على الجسم المخطّط الظهري والمادّة السوداء) فتعمل على مستويات منخفضة، وتختار عضلات وحركات محدّدة تُستخدم لتنفيذ نمط سلوكٍ معيّن.
يساهم الدوبامين في عملية اختيار الفعل على الأقل بطريقتين مهمّتين. الأولى، أنّه يحدّد «العتبة» لبدء الأفعال. كلّما كان نشاط الدوبامين أعلى كلما قلّ الدافع المطلوب لاستثارة تصرّف معيّن. كنتيجة لذلك، تقود مستويات الدوبامين المرتفعة إلى مستويات مرتفعة من النشاط الحركي والسلوك الاندفاعي، أمّا المستويات المنخفضة من الدوبامين فتقود إلى فتور وردّات فعل بطيئة. يتميّز مرض باركنسون -الذي تكون فيه مستويات الدوبامين في مسارات المنطقة السوداء منخفضة بشكل كبير- بالتيبّس وصعوبة في بدء الحركة، لكن حين يواجه الأشخاص المصابون به محفّزاً قويّاً مثل خطر كبير فإن تصرّفاتهم يمكن أن تكون قويّة ونشيطة كنظيراتها لدى الأصحّاء. بشكل معاكس، فيمكن للعقارات التي تزيد إفراز الدوبامين مثل الكوكايين أو الأمفيتامين أن تنتج مستويات نشاط حادّة -بما في ذلك عند الدرجات القصوى- هياج نفسي حركي وحركات نمطية.التأثير الثاني المهمّ للدوبامين هو أنّه يعمل كإشارة «تعليم». عندما يُتبَع فعلٌ ما بحدوث زيادةٍ في نشاط الدوبامين فإنّ مسار (دارة) العقد القاعدية يُعَدَّل بطريقة تجعل نفس الاستجابة أسهل للاستثارة حين تحدث وضعيات مماثلة في المستقبل. هذا نوع من الإشراط الاستثابي ويلعب فيه الدوبامين دور إشارة المكافأة.
المكافأة
توضيح لنُظُم المكافأة دوبامينية الفعل.
في اللغة المستخدمة لمناقشة نظام المكافأة في الدماغ، تُعرّف المكافأة بأنّها الخاصية الجاذبة والمحفّزة في المنبّه، والتي تحثّ على سلوك اشتهائي (ترغّبي) -ويُعرف كذلك بسلوك التقرّب- وبالسلوك الاستهلاكي. المنبّه المكافِئ هو المنبّه الذي يحثّ الكائن على الاقتراب منه واختيارِ استهلاكه. تعدّ اللذّة والتعلّم (الإشراط الكلاسيكي والاستثابي) وسلوك التقرّب هي الوظائف الثلاث للمكافأة. بصفتها جانباً ومظهراً للمكافأة توفّر اللذّة تعريفاً للمكافأة، لكن رغم كون جميع المنبّهات التلذّذية مكافِئة؛ ليست كلّ المنبهات المكافِئة تلذّذية (مثل المكافآت الخارجية كالنقود). يُعكَس الجانب التحفزّي أو الترغيبي للمنبّهات المكافِئة عبر سلوك التقرّب الذي تستحِثُّه، في حين أنّ اللذّة الناتجة من المكافآت الداخلية تنتُج من استهلاك هذه المكافآت بعد الحصول عليها. من النماذج النفسية العصبية التي تميّز هذين المكوّنين للمنبه الداخلي المكافِئ هو نموذج التميّز التحفيزي الذي يقابل فيه «الابتغاء» أو الرغبة (وبشكل أقلّ «السعي») السلوك الاشتهائي أو التقرّبي في حين يقابل «الإعجاب» أو «اللذّة» السلوك الاستهلاكي. يصبح «الابتغاء» لدى البشر المدمنين للعقاقير منفصلاً عن «الإعجاب» مع ازدياد الرغبة في تعاطي العقاقير، في حين أنّ اللذّة المتَحصَّل عليها من التعاطي تنخفض بسبب تحمّل الدواء.يعمل الدوبامين داخل الدماغ جزئياً كإشارة مكافأة عامّة. تُشفِّر استجابةُ دوبامينٍ أوّليةٍ لمنبّه مكافئٍ معلومةً عن تميّز وقيمة وسياق المكافأة. في سياق التعلّم المتّصل بالمكافأة يعمل الدوبامين كذلك كإشارة لخطأِ التنبؤِ بالمكافأة، ويعني ذلك مقدار ودرجة عدم توقّع قيمة المكافأة. تبعاً لهذه الفرضية الخاصة بفولفرام شولتز ، فإنّ المكافآت المتوَقَّعَة لا تُنتِج استجابةَ دوبامينٍ ثانيةٍ في بعض الخلايا دوبامينية الفعل، لكن المكافآت غير المتوَقَّعة أو التي تفوق التوقّع تُنتج زيادةً وجيزة البقاء في الدوبامين المشبكي، بينما يسبّب إغفال مكافأة متوقَّعَة انخفاضاً في تحرير الدوبامين إلى أقلّ من المعدّلات الوسطية. حصلت فرضية «خطأ التنبّؤ» على اهتمامٍ خاصٍّ من المختصّين في العلوم العصبية الحاسوبية، لأنّ هنالك طريقةُ تعلّمٍ حاسوبيةٍ مؤثّرةٍ، تعرَف باسم تعلّم الفرق الزمني، تَستخدِم إشارةً بشكل كبير لتُشفير خطأ التنبؤ. قاد هذا التقارب بين الفرضية والبيانات إلى تآثرات خصبة بين علماء الأعصاب وعلماء الحاسوب المهتمّين بتعلّم الآلة.تُظهِر أدلّة من تسجيلات مسرى مكروي من أدمغة حيوانات أنّ عصبونات الدوبامين في المنطقة السقيفية البطنية (VTA) والمادّة السوداء تُنشَّط بقوّة بواسطة مجموعة متنوّعة من أحداث المكافأة. إنّ عصبونات الدوبامين المستجيبة للمكافأة هذه في السقيفية البطنية والمادّة السوداء حاسمة للإدراك المتعلّق بالمكافأة وتعمل كمكوّن مركزي لنظام المكافأة. تختلف وظيفة الدوبامين في كلّ امتدادٍ محواريِّ من السقيفية البطنية والمادّة السوداء، على سبيل المثال يُعيِّن امتداد قشرة النواة المتّكئة في السقيفية البطنية التميّز المُرغِب «ابتغى» للمنبّهات المكافئة والإلماعات المرتبطة بها، وتُحَدِّث القشرة الجبهية الحجاجية الخاصّة بالسقيفية البطنية قيمة الأهداف المختلفة تماشياً مع تميّزها المرغِب، تتوسّط امتدادات لوزة السقيفية البطنية وحُصَيْنِها تقوية الذكريات المتعلّقة بالمكافأة؛ ولكلا مسارَيْ لبّ النواة المتّكئة الخاصّة بالسقيفية البطنية والجسم المخطّط الخاصّ بالمادّة السوداء دورٌ في تعلّم الاستجابات الحركية التي تسهّل اكتساب منبّهات مكافئة. يبدو أنّ لبعض النشاط داخل امتدادات السقيفية البطنية دوبامينية الفعل صلةٌ بالتنبّؤ بالمكافأة كذلك.
اللذّةفي حين أنّ للدوبامين دوراً مركزيًّا في إحداث «الرغبة» المرتبطة باستجاباتِ تصرّفٍ تقرّبِيٍّ أو اشتهائِيٍّ للمنبّهات المكافئة، أظهرت دراسات مفصّلة أنّ الدوبامين لا يمكن مساواته ببساطة «بالإعجاب» التلذّذي أو المتعة، كما تَبيّنَ من استجابة السلوك الاستهلاكي. للانتقال العصبي للدوبامين دورٌ في بعض -وليس كل- جوانب الإدراك المتعلّق باللذّة، وذلك لأن مراكز اللذّة حُدّدت داخل نظام الدوبامين (قشرة النواة المتّكئة) وخارجه (الشاحبة البطنية والأنوية شبه العضدية). على سبيل المثال، التنبيه الكهربائي المباشر لمسارات الدوبامين باستخدام أقطاب كهربائية مزروعة في الدماغ يتمّ الإحساس به على أنّه تلذّذي، والعديد من أنواع الحيوانات مستعدّة وراغبة في العمل للحصول عليه. تُخفِّض الأدوية المضادّة للذهان مستويات الدوبامين وتميل إلى إحداث انعدام التلذّذ، وهو انخفاضٌ في القدرة على الشعور باللذّة. تزيد العديد من الأفعال التلذّذية مثل الجماع والأكل ولعب ألعاب الفيديو من إفراز الدوبامين. تؤثّر جميع العقاقير التي يمكن إدمانها بشكل مباشر أو غير مباشر على الانتقال العصبي للدوبامين في النواة المتّكئة، وتزيد هذه العقاقير حين يتمّ تناولها بصفة متكرّرة بجرعات مرتفعة التركيز من «الرغبة» إليها، مؤدّيةً إلى تعاطٍ قهريٍّ وإدمان، وذلك عبر تحسّس لتميُّز تحفيزي محتمل. تتضمن العقاقير التي تزيد من تراكيز الدوبامين المشبكي المنشّطات النفسية مثل الميثامفيتامين والكوكايين. تُولّد هذه المنشّطات سلوكياتِ «رغبة»، لكنها لا تعدّل بشكلٍ كبير من تعابير اللذّة أو تغيّر من مستويات الإشباع. مع ذلك، تحدث العقاقير الأفيونية مثل الهيروين والمورفين زيادات في مقدار سلُوكَي «الإعجاب» و«الرغبة». فضلاً عن ذلك، فإنّ الحيوانات التي أصبح فيها مسار الدوبامين السقيفي البطني غير نشط لا تطلب أو تسعى للحصول على الطعام، وستموت جوعاً إن تركت لوحدها، لكن إن وُضِع الطعام في أفواهها ستقوم باستهلاكه وإبداء تعابير تشير إلى التلذّذ.وجدت دراسة سريرية، والتي اهتمت بتقييم تأثير سلف الدوبامين (ليفودوبا) ومضادّ الدوبامين (ريسبيريدون) والعلاج الوهمي على استجابات المكافأة بالنسبة للموسيقى - بما في ذلك مقدار اللذّة التي شُعِر بها أثناء قشعريرات الموسيقى المقاسة بواسطة تغيُّرات في نشاط كهربية الجلد بالإضافة إلى التقديرات الذاتية؛ أنّ التلاعب بالانتقال العصبي للدوبامين ثنائي الاتجاه يُنظّم إدراك اللذّة (خاصّة التأثير التلذّذي للموسيقى) لدى البشر. أوضحت الدراسة أنّ زيادة الانتقال العصبي للدوبامين تعمل كشرطٍ حتميّ في الاستجابات التلذّذية الاستمتاعية للموسيقى لدى البشر.
خارج الجهاز العصبيلا يتجاوز الدوبامين الحاجز الدموي الدماغي، لذا فإنّ تخليقه ووظائفه في الأعضاء الطرفية مستقلٌ إلى حدٍّ كبير عن تخليقه ووظائفه في الدماغ. تدور كمّيّة معتبرة من الدوبامين في الدورة الدموية، لكنّ وظيفته هنالك ليست واضحة بالكامل. يتواجد الدوبامين في بلازما الدم بمستوياتٍ مقاربةٍ لمستويات الإبينيفرين، لكن لدى البشر، فإنّ أكثر من 95% من الدوبامين الموجود في البلازما يكون على شكل كبريتات الدوبامين، وهو مرافق ينتجه إنزيم SULT1A3 العاملة على الدوبامين الحرّ. تُخلّق معظم كبريتات الدوبامين هذه في المسراق الذي يحيط بأجزاءٍ من الجهاز الهضمي. يُعتقد أنّ تخليق كبريتات الدوبامين هو آلية لإزالة سُمِيّة الدوبامين الذي تمّ تناوله عبر الطعام أو إنتاجه عبر عملية هضمية، فمستويات البلازما منه تتضاعف أكثر من 50 مرة بعد تناول وجبة. كبريتات الدوبامين ليس لها دور حيوي معروف ويتم طرحها في البول.يمكن أن تُخلَّق الكمّية الصغيرة نسبياً من الدوبامين غير المرافق في مجرى الدم بواسطة الجهاز العصبي الودّي أو الجهاز الهضمي أو ربما بواسطة أعضاء أخرى. ويمكن أن يعمل على مستقبلات الدوبامين في الأنسجة الطرفية، أو يتعرّض للأيض أو يُحوَّل إلى نورإبينفرين بواسطة إنزيم بيتا-هيدروكسيلاز الدوبامين الذي يُفرَز في مجرى الدم بواسطة لب الغدة الكظرية. تتواجد بعض مستقبلات الدوبامين في جدران الشرايين، حيث تعمل هناك كموسّع وكمثبّط لإفراز النورإبينفرين.
قد تُنشَّط هذه الاستجابات بواسطة إفراز الدوبامين من الجسم السباتي تحت ظروف انخفاض الأكسجين، لكن من غير المعروف إن كانت مستقبلات الدوبامين الشريانية تقوم بأدوار حيوية مفيدة أخرى.
فضلاً عن دوره في تعديل تدفّق الدم، توجد العديد من الأجهزة التي يدور فيها الدوبامين بمناطق محدودة ويؤدّي وظيفة إفراز خارجي أو تأشير نظير صماوي.
من الأجهزة الملحقة التي يلعب فيها الدوبامين دوراً مهمّاً كذلك كلّ من الجهاز المناعي والكليتين والبنكرياس.
يعمل الدوبامين في الجهاز المناعي عبر المستقبلات المتواجدة في الخلايا المناعية، وخاصّة الخلايا اللمفاوية. يمكن للدوبامين كذلك التأثير على الخلايا المناعية في الطحال ونخاع العظام وجهاز الدوران. فضلاً عن ذلك، يمكن تخليق الدوبامين وإفرازه بواسطة الخلايا المناعية في حدّ ذاتها. يقوم التأثير الرئيسي للدوبامين على الخلايا اللمفاوية على تخفيض مستوى تنشيطها، إلّا أنّ الدلالة الوظيفية لهذا النظام غير واضحة، لكنّه يوفّر طريقة ممكنة لحدوث تآثرات بين الجهاز العصبي والجهاز المناعي، وقد يكون له دورٌ في بعض اضطرابات المناعة الذاتية.يتواجد النظام الكلوي دوباميني الفعل في خلايا الكليون بالكلية، حيث تتواجد جميع الأنواع الفرعية من مستقبلات الدوبامين. يُخلَّق الدوبامين هنالك أيضا بواسطة خلايا الكليون ويتم تفريغه في السائل الكليوني. تشمل وظائفه كذلك زيادة تزويد الكليتين بالدمّ، وزيادة معدل الترشيح الكبيبي، وزيادة طرح الصوديوم في البول. ومنه، يمكن أن تقود عيوب في عمل الدوبامين الكلوي إلى انخفاض في طرح الصوديوم وزيادة في تطوّر ارتفاع ضغط الدم. يوجد دليل قوي على أنّه يمكن أن ينتج عن أخطاءٍ في تخليق الدوبامين أو في مستقبلاته عددٌ من الأمراض بما في ذلك الإجهاد التأكسدي والاستسقاء، وكذلك إمّا ارتفاع ضغط الدم الوراثي أو الأساسي. يمكن للإجهاد التأكسدي أن يسبّب بدوره ارتفاع ضغط الدم. يمكن أن تحدث عيوب في هذا النظام بسبب عوامل وراثية أو ضغط الدم المرتفع.إنّ دور الدوبامين في البنكرياس معقّد نوعاً ما. يتكوّن البنكرياس من جزئين: جزء غُدِي خارجي وآخر صمّاوي. يفرز الجزء الغُدي الخارجي إنزيمات هضمية ومواد أخرى -بما في ذلك الدوبامين- في الأمعاء الدقيقة. وظيفة هذا الدوبامين المفرَز بعد دخوله الأمعاء الدقيقة غير واضحة تماماً، ومن الاحتمالات أنّه يحمي الغشاء المخاطي المعوي من التضرّر ويخفّض من الحركة المعدية المعوية (وهي المعدّل الذي يتحرّك به المحتوى داخل الجهاز الهضمي).
تُشكِّل جزر لانغرهانس الجزء الصمّاوي من البنكرياس وتقوم بتخليق وطرح هرمونات منها الإنسولين إلى مجرى الدم. يوجد دليل على أن خلايا بيتّا في هذه الجزر التي تخلق الأنسولين تحتوي على مستقبلات دوبامينية، وأن الدوبامين يعمل على تخفيض كمّية الإنسولين التي تُفرزها. مصدر الدوبامين فيها غير معروف بوضوح، ويمكن أن يأتي من الدوبامين الذي يسري في مجرى الدم والذي مصدره الجهاز العصبي الودّي، أو ربّما يتمّ تخليقه موضعياً بواسطة أنواع أخرى من الخلايا البنكرياسية.
الاستخدامات الطبية
المقالة
الرئيسة: دوبامين (دواء)
تحضير دوبامين HCl، تؤخذ جرعة قنينة واحدة عبر الحقن الوريدي.
يُباع الدوبامين كدواء مُصنَّعٍ تحت الأسماء التجارية: إنتروبين - دوباستات - ريفيمين؛ وأسماء أخرى. وهو في قائمة الأدوية الأساسية النموذجية لمنظمة الصحة العالمية. يُستخدم في الغالب كدواء محفّز في علاج انخفاض ضغط الدم الحادّ وانخفاض معدل دقات القلب وتوقف القلب، وهو مهمّ بشكل خاصّ في معالجة هذه الأمراض لدى الأطفال حديثي الولادة. يُعطى الدوبامين عبر الحقن في الوريد، وبما أنّ عمر النصف الخاص به في البلازما قصير جدا -حوالي دقيقة واحدة عند البالغين، دقيقتين لدى الرُّضّع وحتى خمس دقائق لدى الخُدَّج- فعادةً ما يُعطى عبر معالجة وريدية مستمرّة بدل حقنة واحدة.اعتماداً على الجرعة تشمل تأثيرات الدوبامين: زيادة في طرح الكلى للصوديوم، وزيادة في التبوّل، وزيادة في معدّل دقّات القلب، وزيادة في ضغط الدمّ. عند تناوله بجرعات منخفضة، يعمل عبر الجهاز العصبي الودّي لزيادة قوّة تقلّصات عضلة القلب ومعدّل دقّاته، ومنه زيادة النتاج القلبي وضغط الدم. يمكن للجرعات العالية كذلك التسبّب في تضيق الأوعية التي تسبّب بدورها ضغط الدم. تقول كتب طبية قديمة أن الجرعات المنخفضة جدا يمكن أن تحسّن عمل الكلية من دون آثار جانبية أخرى، لكن خلُصت مراجعات حديثة إلى أن الجرعات المنخفضة بذلك القدر ليست فعّآلة ويمكن أن تكون ضارّة في بعض الأحيان. في حين أن بعض التأثيرات تظهر من تنبيه مستقبلات الدوبامين، تنتج التأثيرات الرئيسية في القلب والأوعية الدموية من الدوبامين العامل على المستقبلات α1 وβ1 وβ2 أدرينالية الفعل.تشمل التأثيرات الجانبية للدوبامين: تأثيرات سلبية على وظيفة الكلية ودقّات قلب غير منتظمة. تمّ تحديد الـLD50 أو الجرعة المميتة التي يُتَوقّع أن تكون مميتة لـ 50% من متناوليها عند: 59 ملغ/كلغ (فأر، حقن وريدي)، 95 ملغ/كلغ (فأر، حقن داخل الصفاق)، 163 ملغ/كلغ (جرذ، حقن داخل الصفاق)، 79 ملغ/كلغ (كلب، حقن وريدي).تتوفر هيئة مفلورة من ليفودوبا تُعرف باسم فلورودوبا للاستخدام في التصوير المقطعي بالإصدار البوزيتروني لتقييم وظيفة المسار السوداوي المخططي.
الأمراض والاضطرابات
المقالة الرئيسة: قائمة الأدوية الدوبامينية
يلعب نظام الدوبامين دوراً مركزياً في العديد من الأمراض الطبّية بما في ذلك مرض باركنسون واضطراب نقص الانتباه مع فرط النشاط ومتلازمة توريت والفصام والاضطراب ثنائي القطب والإدمان. فضلاً عن الدوبامين بحدّ ذاته، فتوجد العديد من العقاقير التي تعمل على أنظمة الدوبامين في أجزاء متنوّعة من الدماغ أو الجسم، ويُستخدم بعضها لأغراضٍ طبّية أو ترفيهية. طوَّرَ علماء الكيمياء العصبية كذلك مجموعةً متنوّعةً من عقاقير الأبحاث التي يرتبط بعضها بإلفة عالية مع أنواع محدّدة من مستقبلات الدوبامين، وتعمل إمّا على تفعيل أو تعطيل تأثيراتها، والعديد من العقاقير التي تؤثّر على جوانب أخرى من فيسيولوجية الدوبامين،
بما في ذلك مثبّطات ناقل الدوبامين ومثبّطات ناقل أحادي الأمين الحويصلي ومثبّطات الإنزيم.
تشيّخ الدماغ
المقالة الرئيسة: شيخوخة الدماغ
ذكرت العديد من الدراسات حدوث انخفاض متعلّق بالعمر في تخليق الدوبامين وكثافة مستقبلات الدوبامين (عدد المستقبلات) في الدماغ. وقد تبيّن أنّ هذا الانخفاض يحدث في منطقة الجسم المخطّط والقشرة الخارجية له. كما تمّ توثيق انخفاضات في المستقبلات D1 وD2 وD3. يُعتقد أنّ انخفاض الدوبامين مع تقدّم العمر مسؤولٌ عن العديد من الأعراض العصبية التي يزيد تواترها مع العمر، مثل انخفاض مدى تحريك الذراع وزيادة في التقبّض. يمكن أن تسبّب تغيّراتُ مستويات الدوبامين كذلك تغيراتٍ في المرونة الإدراكية المتعلقة بتقدّم العمر.تُظهر نواقل عصبية أخرى مثل سيروتونين وحمض الجلوتاميك كذلك انخفاضاً في التخليق مع تقدّم السن.
تصلّب متعددأفادت دراسات أنّ اختلال التوازن في الدوبامين يؤثّر على التعب في التصلّب المتعدد. يمنع الدوبامين لدى المرضى بالتصلّب المتعدّد إنتاج إنترلوكين 17 وIFN-γ بواسطة خلايا الدمّ المحيطية وحيدة النواة.
مرض باركنسونمرض باركنسون هو اضطرابٌ متعلّقٌ بالعمر، ويتميّز باضطرابات في الحركة مثل: تيبّس الجسم وبطء الحركة وارتعاش الأطراف أثناء عدم استخدامها. في المراحل المتقدّمة يتطوّر المرض إلى الخرف ثمّ إلى الوفاة في النهاية. تحدث الأعراض الأساسية بسبب فقدان الخلايا المفرِزة للدوبامين في المادّة السوداء. هذه الخلايا الدوبامينية عرضة بشكلٍ خاصّ للتضرّر بما في ذلك: التهاب الدماغ والارتجاجات الرياضية المتكرّرة، وبعض أنواع التسممات الكيميائية بموادٍ مثل MPTP؛ حيث تؤدّي تلك الأضرار إلى خسارة معتبرة لهذه الخلايا تنتج عنها متلازمة باركنسون مماثلة في خصائصها الرئيسية لمرض باركنسون.
إنّ معظم حالات مرض باركنسون مجهولة السبب ولا يمكن فيها تحديد سبب موت الخلايا.
العلاج الأكثر شيوعاً واستخداماً لمعالجة باركنسون هو تناول ليفودوبا السلف الأيضي للدوبامين. يحوَّل ليفودوبا إلى دوبامين في الدماغ وأنحاء مختلفة من الجسم بواسطة الإنزيم نازعة كربوكسيل دوبا. يُستخدم مركب ليفودوبا بدل الدوبامين في حدّ ذاته لأنه -بخلاف الدوبامين- قادرٌ على تجاوز الحاجز الدموي الدماغي. وغالباً ما يتمّ تناوله مع مثبط إنزيم لنزع كربوكسيلٍ محيطي مثل كاربيدوبا أو بنسيرازيد، لتخفيض الكمّية المحوّلة إلى دوبامين في المنطقة المحيطية وبالتالي زيادة كمّية ليفودوبا التي تدخل إلى الدماغ. حين يتمّ تناول ليفودوبا بانتظام لمدّة طويلة، عادةً ما تبدء مجموعة متنوّعة من الآثار الجانبية غير السارّة بالظهور مثل خلل الحركة، ورغم ذلك فإنّ ليفودوبا يعتبر أفضل خيار للعلاج طويل الأمد لمعظم حالات مرض باركنسون.لا يمكن للعلاج بليفودوبا استعادة الخلايا الدوبامينية المفقودة، لكنه يتسبّب بأن تقوم الخلايا المتبقية بإنتاج المزيد من الدوبامين، ومنه تعويض الكمية المطلوبة منه ولو بدرجة معينة. في المراحل المتقدّمة يبدأ العلاج بالفشل لأنّ فقدان الخلايا يكون كبيراً لدرجة أنّ الخلايا المتبقيّة لا يمكنها إنتاج الدوبامين بشكل كافٍ، وذلك بغضّ النظر عن مستويات ليفودوبا. بعض الأدوية التي تحسّن من وظيفة الدوبامين مثل بروموكريبتين وبيرغوليد تُستخدم أحياناً كذلك لعلاج الباركنسونية، لكن في معظم الحالات وجد أن ليفودوبا يُعطي أفضل مفاضلة بين التأثيرات الإيجابية والتأثيرات الجانبية السلبية.الأدوية دوبامينية الفعل التي تُستخدم لعلاج مرض باركنسون يصاحبها في بعض الأحيان تطوّر متلازمة خلل تنظيم الدوبامين، والتي تتضمّن الاستخدام المفرط للدواء دوباميني الفعل والدواء الحاثّ على القيام القهري بنشاطات مكافأة طبيعية مثل القمار والجماع. هذه التصرّفات مماثلة للتصرّفات الملاحظَة لدى الأفراد المرضى بإدمان سلوكي.
إدمان
العقاقير والمنشطات النفسية
يزيد الكوكايين من مستويات الدوبامين عبر إعاقة ناقلات الدوبامين التي تعيد نقل الدوبامين إلى النهاية المشبكية بعد إفرازه.
المقالة الرئيسة: إدمان
تمارس
العقاقير، مثل الكوكايين ومشتقّات الأمفيتامين (بما في ذلك الميثامفيتامين)
وآديرال وميثيل فينيدات (المسوَّق باسم ريتالين أو كونسيرتا) وMDMA
وغيرها من المنشّطات النفسية، تأثيراتها جزئياً أو
كلّياً عبر زيادة مستويات الدوبامين في الدماغ عبر آليات متنوّعة. الكوكايين
وميثيل فينيدات هي مركّبات معيقة للنواقل أو مثبّطات استرداد والتي تثبّط بشكل غير
تنافسي استرداد الدوبامين، وهذا يتسبّب في زيادة تراكيز الدوبامين في الشقّ
المشبكي. كما هو الحال مع الكوكايين، تزيد كلّ من مشتقّات الأمفيتامين
والأمفيتامين تراكيز الدوبامين في الشقّ المشبكي، لكن بآلياتٍ مختلفة.تشمل تأثيرات
المنشّطات النفسية زيادةً في معدّل دقّات القلب وحرارة الجسم والتعرّق وتحسّن في
اليقظة والانتباه والتحمّل، بالإضافة إلى زيادة في اللذّة الناتجة عن نشاطات
مكافئة؛ أمّا الجرعات المرتفعة فتحدث حالات هياج وقلق وحتّى فقدان الارتباط بالواقع.
إنّ إمكانية إدمان العقاقير عالية بسبب تأثيراتها التنشيطية على نظام المكافأة
بواسطة الدوبامين في الدماغ. مع ذلك فبعض هذه العقاقير يمكن أن يكون مفيداً -عند
جرعات منخفضة- لعلاج اضطراب نقص الانتباه مع فرط النشاط وكذلك النوم القهري. من
عوامل التفريق المهمّة بين هذه العقاقير هو بداية ومدّة تأثيراتها، فالكوكايين
يحدِث مفعوله بعد ثوانٍ من حقنه أو استنشاقه على هيئة قاعدة حرّة وتدوم تأثيراته
من 5 إلى 90 دقيقة. هذه الوظيفة السريعة والقصيرة تجعل تأثيراته سهلة الملاحظة
وتعطيه احتمالية إدمان عالية. على العكس، فإنّ ميثيل فينيدات المتناول على شكل
حبوب يمكن أن يستغرق ساعتين ليصل إلى قمّة مستوياته في مجرى الدم، وحسب التكوين
يمكن أن تدوم تأثيراته حتّى 12 ساعة. هذه التأثيرات البطيئة والمستمرّة تخفّض من
إمكانية إساءة الاستخدام وتجعل ميثيل فينيدات أكثر فائدة في علاج اضطراب نقص
الانتباه مع فرط النشاط.
هيدروكلوريد الميثامفيتامين المعروف كذلك باسم «كريستال ميث».
تُحدث مجموعة متنوّعة من العقاقير المسبّبة للإدمان زيادة في نشاط الدوبامين المتعلّق بالمكافأة. تعزّز المنشّطات مثل النيكوتين والكوكايين والميثامفيتامين زيادة مستويات الدوبامين، والتي تبدو أنّها العامل الأساسي في التسبّب بالإدمان. بالنسبة للعقاقير الأخرى المسبّبة للإدمان مثل هيروين أشباه الأفيونيات، مستويات الدوبامين المرتفعة في نظام المكافأة قد تلعب دوراً صغيراً فقط في الإدمان. حين يمرّ الأفراد المدمنون للمنشطات عبر فترة الامتناع، فإنّهم لا يشعرون بالمعاناة الجسدية المصاحبة للامتناع عن الكحول أو الأفيون، وبدل ذلك يشعرون باشتهاء ورغبة شديدة للمخدّر يميّزها تهيّج وتململ وأعراض تيقّظ أخرى،
ناجمة عن إدمان نفسي.
يلعب نظام الدوبامين دوراً حاسماً في جوانب عدّة من الإدمان. في المرحلة المبكّرة، يمكن للفوارق الجينية التي تغيِّر التعبير عن مستقبلات الدوبامين في الدماغ التنبّؤُ بما إن كان الشخص سيجد المنشّطات جذابة أو منفّرة. يُنتِج استهلاك المنشّطات زيادةً في مستويات الدوبامين في الدماغ تستمرّ من عدّة دقائق إلى ساعات. أخيراً، تثير الزيادة المزمنة في الدوبامين التي تصاحب الاستهلاك المتكرّر لجرعات عالية من المنشّط مجموعةً متنوّعةً من التغيُّرات البنيوية في الدماغ والتي تكون مسؤولة عن السلوكيّات غير العادية التي تميّز الإدمان. إنّ معالجة إدمان المنشّطات يحتاج إلى دعم ومساعدة، لأنه حتّى لو توقّف استهلاك المنشّط فإنّ الرغبة الشديدة المصاحبة للامتناع النفسي لا تتوقّف. حتى حين يبدو أنّ الرغبة الشديدة قد اندثرت، يمكن أن تعاود الظهور عند مواجهة إلماعات ذات صلة بالعقار مثل: الأصدقاء والأماكن والحالات؛ إذ أنّ شبكات الترابط في الدماغ متشابكة بشكل كبير.
الذهان والأدوية المضادّة للذهان
ذهان
اكتشف الأطباء النفسانيون في خمسينات القرن العشرين أنّ قسماً من العقاقير المعروفة بالمضادّات النمطية للذهان (المعروفة كذلك بالمهدّئات الكبرى) فعّآلة غالباً في تخفيض الأعراض النفسية الخاصّة بالفصام. أدّى إنتاج أوّل دواء مضادّ للذهان وهو كلوربرومازين (ثورازين) منتصف القرن العشرين إلى إطلاق سراح العديد من المرضى بالفصام من المصحّات في السنوات التي تلت إنتاجه. بحلول سبعينات القرن العشرين فهم العلماء أنّ هذه المضادّات النمطية للذهان تعمل كمناهضات لمستقبلات D2. قاد هذا الفهم إلى ما يُزعم بأنه فرضية الدوبامين الخاصة بالفصام والتي تفترض أنّ السبب الرئيسي للفصام هو النشاط الفائق لأنظمة الدوبامين في الدماغ. حصلت فرضية الدوبامين على دعم إضافي من ملاحظة أنّ الأعراض الذهانية كانت تزيد حدّتها عند تناول المنشّطات المحسِّنة لإنتاج الدوبامين مثل الميثامفيتامين، وأنّ هذه العقاقير يمكنها كذلك إحداث ذهان لدى الأشخاص الأصحّاء إن تمّ تناولها بجرعات كبيرة بالشكل الكافي. خلال العقود اللاحقة في أواخر القرن العشرين تمّ تطوير مضادّات نمطية أخرى للذهان ذات أعراض جانبية خطيرة أقلّ. لا تعمل العديد من هذه الأدوية الجديدة مباشرة على مستقبلات الدوبامين، وبدل ذلك تُحدث تغييرات في نشاط الدوبامين بشكل غير مباشر. استُخدمت هذه الأدوية كذلك لمعالجة ذهانات أخرى.
للأدوية المضادّة للذهان تأثيرُ تثبيطٍ واسع على معظم أنواع السلوك النشط وتُخفّض بشكل خاصّ سلوكَي الوهام والتهيّج المميِّزَين للذهان الصريح. رغم ذلك، لا يزال هناك خلاف كبير حول مقدار التحسّن الذي يشعر به المريض المتناوِل لهذه الأدوية.
تسبّبت ملاحظات لاحقة في فقدان فرضية الدوبامين لشعبيتها، على الأقلّ على هيئتها الأصلية البسيطة. أحد الأسباب هو أنّ المرضى بالفصام لا يُظهِرون زيادة نمطية معتبرة في مستويات نشاط الدوبامين بالدماغ.
وربما أهمّ الأسباب هو أنّ تلك الأدوية التي تخفّض نشاط الدوبامين غير جيّدة إطلاقاً لمعالجة الفصام: فهي لا تخفّض سوى مجموعة فرعية من الأعراض، في حين أنّها تنتج آثاراً جانبية حادّة قصيرة وطويلة المدى. رغم ذلك، يستمرّ العديد من الأطبّاء النفسانيون وعلماء الأعصاب في الاعتقاد بأن سبب الفصام هو نوع من الاختلال الوظيفي لنظام الدوبامين. مع تطوّر فرضية الدوبامين بمرور الوقت أصبحت أنواع الاختلالات الوظيفية التي تفترضها تميل لأن تكون معقّدة وصعبة التمييز والإدراك.
الانتشار الواسع لاستخدام مضادّات الذهان مازال محلّ جدلٍ منذ فترة طويلة، وتوجد عدّة أسباب لذلك: أوّلها أنّ المرضى المتناولين للأدوية المضادّة للذهان يعتبرونها مُكرِّهة جدّاً، لأنّها تسبب بلادة عامّة في الفِكر وتمنع القدرة على الشعور باللذّة والمتعة. ثانيها أنّه من الصعب إظهار أنّها تعمل بشكل محدّد ضدّ سلوكيّات ذهانية بدل مجرّد كبت جميع أنواع السلوك النشط. ثالثها أنّها يمكن أن تُحدث آثاراً جانبية خطيرة تشمل زيادة الوزن والسكري واضطرابات جنسية وحدوث تغيّرات هرمونية، بالإضافة إلى إمكانية حدوث نوع خطير من اضطرابات الحركة يسمّى خلل الحركة المتأخر.
بعض هذه الآثار الجانبية يمكن أن يستمرّ لمدّة طويلة بعد التوقّف عن تناول الدواء، ويمكن حتّى أن تستمرّ بشكل دائم.
اضطراب نقص الانتباه مع فرط النشاطللانتقال العصبي المتغيّر دورٌ في اضطراب نقص الانتباه مع فرط النشاط (ADHD) وهو حالة تصاحبها وظائف تنفيذية معتلّة تؤدّي بدورها إلى مشاكل في تنظيم الانتباه (تحكم انتباهي) وتثبيط السلوكيّات (تحكم تثبيطي) ونسيان الأحداث أو عدم الانتباه للتفاصيل (ذاكرة عاملة) ومشاكل أخرى. توجد صلات جينية بين مستقبلات الدوبامين وناقل الدوبامين والـADHD بالإضافة إلى صلات مع مستقبلات نواقل عصبية أخرى وناقلاتها. العلاقة الأكثر أهمّية بين الدوبامين والـADHD تتضمّن العقاقير المستخدمة في علاجه. بعض أكثر العوامل فعالية في علاج الـADHD هي المنشّطات النفسية مثل ميثيل فينيدات (ريتالين، كونسيرتا) وأمفيتامين (آديرال، ديكسيدرين)، والعقاقير التي تزيد مستويات كلٍّ من الدوبامين والنورإبينفرين في الدماغ. التأثيرات السريرية لهذه المنشّطات النفسية في معالجة اضطراب نقص الانتباه مع فرط النشاط تتمّ عبر التفعيل غير المباشر لمستقبلات الدوبامين والنورإبينفرين، خاصّة مستقبل الدوبامين D1 والمستقبل الأدرينالي A2 في القشرة أمام الجبهية.
الألميلعب الدوبامين دوراً في معالجة الألم في مناطق متعدّدة من الجهاز العصبي المركزي تشمل: النخاع الشوكي والسنجابية المحيطة بالمسال والمهاد والعقد القاعدية والقشرة الحزامية. لمستويات الدوبامين المنخفضة صلة بأعراض مؤلمة متواترة الحدوث في مرض باركنسون. تظهر الانتقالات العصبية دوبامينية الفعل غير الطبيعية في عدّة حالات سريرية مؤلمة منها: متلازمة الفم الحارق والألم العضلي الليفي ومتلازمة تململ الساقين.
الغثيانيُحدَّد الغثيان والتقيؤ بشكل كبير بالنشاط في الباحة المنخفضة في بصلة جذع الدماغ بمنطقة تعرف باسم منطقة حث المستقبل الكيميائي. تحتوي هذه المنطقة على كمية كبيرة من مستقبلات الدوبامين D2. وكنتيجة لذلك، تكون لدى العقاقير التي تنشّط مستقبلات D2 إمكانية عالية لإحداث الغثيان. تشمل مجموعة العقاقير هذه بعض الأدوية التي توصف لمرض باركنسون وكذلك بعض ناهضات الدوبامين مثل الآبومورفين.
في بعض الحالات، مناهضات المستقبل D2 مثل ميتوكلوبراميد مفيدة للاستعمال كمضادات للقيء.
علم الأحياء المقارن
الأحياء الدقيقةلا توجد تقارير على وجود الدوبامين في البكتريا العتيقة، ولكنّه اكتشف في بعض أنواع البكتريا وفي بعض الكائنات الأولية مثل رباعية الغشاء. ومن جهة أخرى، تحوي بعض أنواع البكتريا على كافّة الإنزيمات المشابهة بالنسق للإنزيمات التي تستخدمها الحيوانات لاصطناع الدوبامين. جرى اقتراح أنّ الحيوانات حصلت على آلية اصطناع الدوبامين من البكتريا عن طريق نقل الجينات الأفقي، الذي يمكن أن يكون قد حصل بوقت متأخّر نسبياً قياساً على زمن التطوّر، وربّما يعود ذلك نتيجةً للتضمين التعايشي التكافلي للبكتريا في خلايا حقيقيات النوى الذي أدّى إلى نشوء المتقدرات (الميتوكندريون).
الحيواناتيُستخدم الدوبامين ناقلاً عصبياً في معظم الحيوانات متعدّدة الخلايا. ففي الإسفنجيات بيّّنَ تقرير واحد على وجود الدوبامين، من غير الدلالة على دوره الوظيفي؛ إلّا أنّه بالمقابل توجد عدّة تقارير على وجود الدوبامين في الجهاز العصبي للعديد من الأنواع الأخرى، ومن ضمنها قنديل البحر اللاسع والهيدرا والمرجان.
يشير هذا الأمر إلى أنّ ظهور الدوبامين ضمن النواقل العصبية يعود إلى أقدم أشكال الجهاز العصبي، وذلك تقديرياً إلى أكثر من حوالي 500 مليون سنة في العصر الكامبري.
يؤدّي الدوبامين دورَ الناقل العصبي في الفقاريات وشوكيات الجلد ومفصليات الأرجل والرخويات والعديد من أنواع الديدان. يقوم الدوبامين في أنواع الحيوانات التي تحويه بتعديل أو تحوير السلوك الحركي. وفي عددٍ من الدراسات على النماذج الحية وُجد أنّ الدوبامين يقلّل من حركة الربداء الرشيقة، وهي نوع من أنواع الديدان الأسطوانية، لكنّه يزيد من الحركات الباحثة عن الغذاء؛ أمّا في الديدان المسطّحة فيعمل الدوبامين على زيادة الحركات اللولبية؛ أمّا في العلقيات فهو يثبّط من السباحة، لكنّه يحفّز الزحف. أمّا في الفقاريات فهو يقوم في أغلبها بدور منشّط وله تأثير على تبدّل السلوك وانتقاء التجاوب، وذلك بشكل مماثل لتأثيره في الثدييات. وُجد أيضاً أنّ للدوبامين في جميع مجموعات الحيوانات دورٌ في التعلّم بأسلوب المكافأة؛ وهذه الملاحظة تنسحب أيضاً على بعض أنواع اللافقاريات مثل الديدان والرخويات ومفصليات الأرجل مثل ذبابة الفاكهة الشائعة، والتي يمكن أن تُدرَّب لتكرِّرَ فعلاً ما، إذا كان متبوعاً بشكلٍ متّسقٍ بزيادة مستويات الدوبامين. كان يُظن في البداية أن مفصليات الأرجل تمثل استثناءً لأثر الدوبامين على مملكة الحيوانات، إذ وجد البعض أنه يعطي معها مفعولاً عكسياً، وأنّ نظام المكافأة كان يفعّل بواسطة الأكتوبامين، وهو ناقل عصبي ذي صلة بالنورإبينفرين؛ إلّا أنّ الدراسات الأخيرة على ذبابة الفاكهة بيّنت أنّ للدوبامين بالفعل دور بالتعلّم وفق نظام المكافأة، وأن التحفيز باستخدام الأكتوبامين يعود إلى تنشيط العصبونات الدوبامينية.
النباتات

يمكن أن يوجد الدوبامين في فاكهة الموز سواءً في القشرة أو اللبّ.
تقوم أنواعٌ مختلفة من النباتات باصطناع الدوبامين بدرجات مختلفة. وُجد أعلى تركيز لهذه المادّة في الموز الأحمر والأصفر بمستويات تتراوح بين 40 إلى 50 جزء في المليون وزناً. عُثرَ على تراكيز من الدوبامين بحوالي جزء واحد في المليون أو أكثر بقليل في كلّ من البطاطا والأفوكادو والقنبيط الأخضر وكرنب بروكسل؛ بالمقابل فإنّ البرتقال والطماطم والسبانخ والفاصولياء وعدد من النباتات الأخرى تحوي مستويات من الدوبامين قابلة للقياس وتبلغ أقلّ من جزء واحد في المليون. يُصطنَع الدوبامين في النباتات انطلاقاً من الحمض الأميني تيروسين، وذلك وفق آلية كيميائية حيوية شبيهة لما تجري في مملكة الحيوانات. لم تتضّح الصورة بعد بالنسبة لدور الدوبامين في النباتات، لكن توجد دلائل أنّه يلعب دوراً في الاستجابة للعوامل المجهدة مثل العدوى البكترية، كما يقوم بدور عامل محفّز للنموّ في بعض الحالات، كما يقوم بتحوير وتعديل أسلوب استقلاب السكريات. رغم ذلك، فإنّ المستقبلات التي تتوسّط القيام بهذه الأفعال لم تحدّد بعد، لا هي ولا الآليات بين الخلوية التي تنشّطها. تُستقلَب هذه المادة في النباتات بعدّة طرق بشكل ينتج الميلانين وعددٍ مختلف من أشباه القلويات كمنتجات ثانوية. تعدّ مركّبات الميلانين من المواد الصباغية الداكنة، والتي توجد في عددٍ كبير من أطياف الكائنات الحية، وهي قريبة من حيث البنية الكيميائية من الدوبامين؛ كما يوجد نوع من الميلانين يعرف باسم «دوبامين-ميلانين» والذي يمكن اصطناعه من أكسدة الدوبامين بواسطة إنزيم تيروسيناز. يَستخدم بعض الدوبامين في النباتات غالباً مادّةً بادئة في اصطناع دوبامين-ميلانين. هناك دلائل على وجود مادة دوبامين-ميلانين في الحيوانات. يعتقد أنّ الزخارف المعقّدة على أجنحة الفراشات، وكذلك التخطيطات ذات اللونين الأبيض والأسود الموجودة على أجسام بعض يرقات الحشرات، هي ناتجة عن تراكمات بنيوية مهيكلة من مركّب دوبامين-ميلانين. لا ينتمي الميلانين الموجود في جسم الإنسان والمسؤول عن تدكين لون البشرة إلى الصنف المذكور آنفاً، إذ أنّه يُصطنع في الجسم عبر مسار يستخدم ليفودوبا مادّةً بادئة وليس الدوبامين. بالرغم من ذلك، فإنّ هناك دلائل تشير إلى أنّ الميلانين العصبي الذي يسبّب لون المادة السوداء في الدماغ، قد يكون، ولو بجزء منه على الأقل، مؤلّفاً من دوبامين-ميلانين.لا يؤثّر الدوبامين المستهلك غذائياً على الدماغ، لأنّه لا يقدر على عبور الحاجز الدموي الدماغي؛ إلّا أنّ هناك العديد من النباتات الحاوية على ليفودوبا، وهو طليعة الدوبامين الاستقلابية، ووُجدت أعلى تراكيز منها في نبتة الميقونة، وخاصّة الميقونة الشهوانية (الاسم العلمي: Mucuna pruriens)، والتي تستخدم مصدراً لها في صناعة العقاقير. كما عثر على مستويات مرتفعة من ليفودوبا في نبات الفول، وذلك بشكل أكبر في القشور والأجزاء الأخرى من النبتة بالمقارنة مع الحبوب.
وجد أيضاً أن بذور أشجار السنا والبوهينيا تحوي كمّيات معتبرة من الليفودوبا.
تاريخ الأبحاثاصطُنِع الدوبامين لأوّل مرّة سنة 1910 من الكيميائي جورج بارغر وزميله جيمس إونز في مختبرات ويلكم في لندن؛
وسُمّي بهذا الاسم للإشارة إلى بنيته الكيميائية، إذ أنّ المركّب يُستحصَل من سلفه المركّب الطليعي ثنائي هيدروكسي فينيل ألانين dihydroxyphenylalanine والذي يرمز له اختصاراً DOPA؛ كما أنّ الدوبامين يحوي مجموعة أمين وظيفية، وبذلك يصبح الاسم بالكامل دوبامين.
اكتشف العالم السويدي أرفيد كارلسون ومساعديه دور الدوبامين الوظيفي في النقل العصبي في الدماغ سنة 1958؛ وحاز بسبب هذا الاكتشاف على جائزة نوبل في علم وظائف الأعضاء سنة 2000، إذ بيَّنَ كارلسون أنّ الدوبامين ليس مجرّد مركّب وسطي في اصطناع النورإبينفرين، ولكنّه ناقل عصبي أيضاً.
بولي دوبامينوجدت بعض الأبحاث سنة 2007 أنّ وضع العديد من المواد في محلول متوسّط القلوية من الدوبامين سيؤدّي إلى تغطيتها بطبقة من الدوبامين المتبلمر، والذي أشير إليه باسم بولي دوبامين. يُستحصل على هذا الشكل المبلمر من الدوبامين من تفاعل أكسدة تلقائية، وهو بنيوياً يعدّ نوعاً من الميلانين.
يمكن اصطناع بولي دوبامين من تفاعل ملح هيدروكلوريد الدوبامين مع مركّب تريس القاعدي في الماء؛ ولا تزال بنية الشكل البوليميري من الدوبامين غير معروفة. يتشكّل غطاء من طبقة البولي دوبامين على الأجسام المغموسة في محلول التحضير، وهي يمكن أن تتفاوت في حجمها من الجسيمات النانوية إلى الأسطح الكبيرة. لا تزال الأبحاث مستمرّة في إيجاد تطبيقات مناسبة لهذه المادة، ومن ضمن الاقتراحات استخدامها في تغليف الأدوية؛ أو استغلال خواصّها اللاصقة كركيزة في المستشعرات الحيوية.
انظر أيضًاقائمة الأدوية الدوبامينية
هوامش
يرمز له اختصاراً DA وذلك من التسمية الكيميائية النظامية dihydroxyphenethylamine: ثنائي هيدروكسي فينئيثيلامين
Annica Dahlström و Kjell Fuxe
بالإنجليزية wanting وتعني الابتغاء أو الإرادة
بالإنجليزية desire وتعني الرغبة أو التوق
بالإنجليزية seeking وتعني السعي للحصول على أو نشد (الأمر).
بالإنجليزية liking وتعني الإعجاب أو المحبة.
بالإنجليزية pleasure وتعني المتعة أو اللذة.
Wolfram Schultz
James Ewens
=======
الأيض
من ويكيبيديا، الموسوعة الحرة
شرح
مبسط للأيض في خلية . 
المكونات الرئيسية
جزيء حيوي-تمثيل غذائي- مترادفات
الأيض أو الاستقلاب ( Metabolism)
هو مجموعة من التفاعلات الكيميائية في خلايا الكائن تحافظ على الحياة. الأهداف الرئيسية الثلاث للأيض هي تحويل الغذاء/الوقود إلى طاقة لتشغيل العمليات الخلوية، وتحويل الغذاء/الوقود إلى وحدات بناء للبروتينات، والدهون، والأحماض النووية، وبعض السكريات، وإزالة الفضلات الأيضية النيتروجينية. تلك التفاعلات التي تحفزها إنزيمات تسمح للكائنات بالنمو والتكاثر، والمحافظة على تركيبها، والاستجابة للبيئة. يمكن أن يشير مصطلح الأيض كذلك إلى مجموع كل التفاعلات الكيميائية التي تحدث في الكائنات الحية، بما فيها الهضم ونقل المواد إلى وبين الخلايا المختلفة، وفي تلك الحالة تسمى التفاعلات داخل الخلايا أيض وسيط أو أيض متوسط.
يتم تقسيم الأيض عادة إلى فئتين: التقويض، أي تكسير المواد العضوية، على سبيل المثال، تكسير الجلوكوز إلى حمض البيروفيك، عن طريق التنفس الخلوي، وابتناء، أي بناء مكونات الخلايا مثل البروتينات والأحماض النووية. عادة، يحرر التقويض طاقة فيما يستهلك الابتناء الطاقة.
يتم تنظيم تفاعلات الأيض الكيميائية في مسارات أيضية، يتم من خلالها تحويل مركب كيميائي لآخر عبر سلسلة من الخطوات بواسطة سلسلة من الإنزيمات. تعتبر الإنزيمات مصيرية بالنسبة للأيض لأنها تسمح للكائنات بتنفيذ تفاعلات مرغوب بها تحتاج للطاقة ولن تحدث بنفسها دون الإنزيمات، حيث تقوم الإنزيمات بدمجها بتفاعلات تلقائية تحرر طاقة. تعمل الإنزيمات كمحفزات تسمح بحدوث التفاعلات بشكل أسرع. تسمح الإنزيمات كذلك بتنظيم المسارات الأيضية استجابةً للتغيرات في بيئة الخلية أو لإشارات من خلايا أخرى.
يحدد النظام الأيضي لكائن معين أي المواد ستكون مغذية وأيها تكون سامة. على سبيل المثال، بعض بدائيات النوى تستخدم كبريتيد الهيدروجين كمغذي، إلا أن هذا الغار سام للحيوانات. تؤثر سرعة الأيض، ومعدل الأيض على كم الغذاء الذي سيحتاجه الكائن، وكذلك على قدرته على الحصول على ذلك الغذاء.
السمة اللافتة في عملية الأيض هي تشابه المسارات والمكونات الأيضية الأساسية بين الأنواع المختلفة إلى حد كبير. على سبيل المثال، مجموعة الأحماض الكربوكسيلية التي تشتهر بكونها مركبات وسيطة في دورة حمض الستريك تتواجد في كل الكائنات المعروفة، حيث وجدت في كائنات متباينة للغاية كبكتيريا إشريكية قولونية وحيدة الخلية والكائنات العملاقة متعددة الخلايا مثل الأفيال.
التسميات العربيةتختلف ترجمة المصطلح العلمي metabolism باختلاف الدول العربية حيث تستخدم تسمية أيض في مصر وفلسطين والأردن والسعودية والعراق والإمارات واليمن وليبيا والجزائر والكويت. فيما تستخدم تسمية استقلاب في سوريا. كما تستخدم تسمية تمثيل غذائي في مصر أيضا.
المواد الكيميائية الحيوية الرئيسية
مزيد
من المعلومات: جزيء حيوي، خلية والكيمياء الحيوية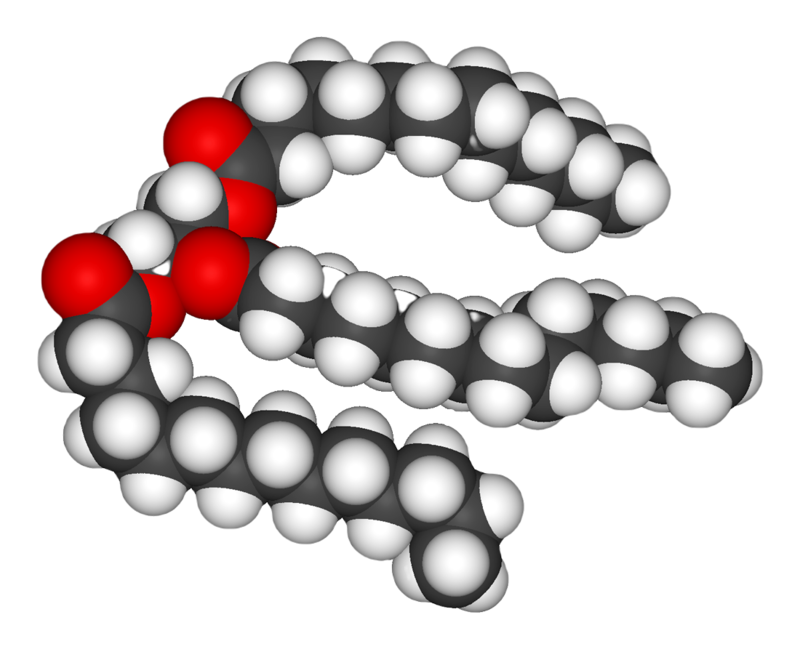
هيكل ثلاثي الغليسريد ، عبارة عن جزيء غليسرين (أحمر) يرتبط به 3 أحماض دهنية (رمادي وأسود)؛ ثلاثي الغلسريد هو جزيء دهني يمكن أن يختزن في الخلايا الدهنية.
معظم الهياكل التي تشكل الحيوانات، النباتات والميكروبات تتكون من ثلاث فئات أساسية من الجزيئات: حمض أميني، الكربوهيدرات والدهنيات (وتسمى في كثير من الأحيان الدهون). وهي مصدر الطاقة المختزنة في الجسم لاستخدامها وقت المجاعة أو أثناء الصوم. حيث أن هذه الجزيئات الحيوية للحياة، التفاعلات الأيضية إما تركز على جعل هذه الجزيئات أثناء بناء الخلايا والأنسجة، أو تقسيمها واستخدامها كمصدر للطاقة، وعن طريق الهضم. هذه المواد الكيميائية الحيوية يمكن أن تدمج معا لصنع مبلمرات مثل الحمض النووي الريبوزي المنقوص الأكسجين والبروتينات، الجزيئات الأساسية للحياة.
نوع الجزيء اسم الأشكال المونومرية اسم الأشكال المبلمرية أمثلة على الأشكال المبلمرية
حموض أمينية حموض أمينية بروتينات (تسمى أيضا عديدات الببتيد) بروتينات ليفية وبروتينات كروية
كربوهيدرات سكريات أحادية سكريات متعددة النشا، الغلايكوجين والسليلوز
حموض نووية نيوكليوتيدات عديدات النيوكليوتيد حمض نووي ريبوزي منقوص الأكسجين وحمض نووي ريبوزي
الأحماض الأمينية والبروتينات
تتكون البروتينات من أحماض أمينية مرتبة في سلسلة طولية ترتبط معا بروابط ببتيدية. العديد من البروتينات هي إنزيمات تحفز التفاعلات الكيميائية في الأيض. تمتلك البروتينات الأخرى وظائف هيكلية أو ميكانيكية، مثل البروتينات التي تشكل الهيكل الخلوي، وهو نظام من السقالة يحافظ على شكل الخلية. كذلك فإن البروتينات مهمة في تأشير الخلية، واستجابة المناعة، والتصاق الخلايا، والنقل النشط عبر الأغشية، ودورة الخلية. تساهم الأحماض الأمينية أيضا في أيض الطاقة الخلوي عن طريق توفير مصدر للكربون للدخول في دورة حمض الستريك، بالأخص حين يكون مصدر الطاقة الرئيسي، مثل الجلوكوز، نادرًا، أو حين تكون الخلايا تحت إجهاد أيضي.
الدهون
الدهون هي المجموعة الأكثر تنوعًا من المواد الكيماوية الحيوية. استخداماتها الهيكلية الرئيسية هي كونها جزء من الأغشية الحيوية سواء الداخلية أو الخارجية، مثل غشاء الخلية، أو كمصدر للطاقة. تُعرف الدهون عادة على أنها جزيئات حيوية كارهة للماء أو مزدوجة الألفة ولكن تذوب في المذيبات العضوية مثل البنزين أو كلوروفورم. الدهون هي مجموعة كبيرة من المركبات التي تحتوي على أحماض دهنية وغليسرول، جزئ غليسرول مرتبط بـ3 إسترات أحماض دهنية يسمى ثلاثي الغليسريد. تتواجد العديد من التنوعات على الهيكل الأساسي، بما في ذلك هياكل بديلة مثل سفينغوزين في الشحميات السفينجولية، ومجموعات محبة للماء مثل الفوسفات في الدهن الفسفوري. ستيرويدات مثل الكولسترول هي فئة أخرى كبيرة من الدهون.
السكريات
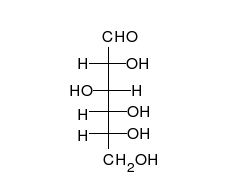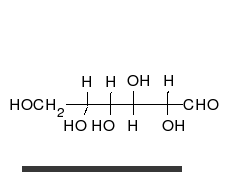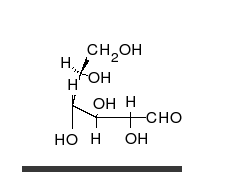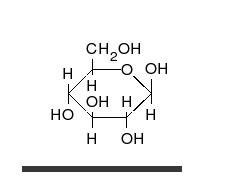
الجلوكوز يمكن أن يتواجد في شكل سلسلة مستقيمة أو حلقة.
الكربوهيدرات هي ألدهيدات أو كيتونات، مع العديد من مجموعات الهيدروكسيل المرتبطة بها. يمكنها التواجد في صورة سلاسل مستقيمة أو حلقات. السكريات هي الجزيئات الحيوية الأكثر وفرة، وتؤدي العديد من الأدوار، مثل تخزين ونقل الطاقة (نشا، وغلايكوجين)، وكونها مكونات هيكلية (سليولوز في النبات، وكيتين في الحيوانات). تسمى وحدات السكريات الأساسية سكر أحادي وتشمل جالاكتوز، وفركتوز، والأهم الجلوكوز. يمكن أن ترتبط السكريات الأحادية معا لتكوين متعدد السكاريد.
النوكليوتيدات الحمضان النوويان، حمض نووي ريبوزي منقوص الأكسجين (DNA) وحمض نووي ريبوزي (RNA) هما بوليمران للنوكليوتيدات. يتكون كل نوكليوتيد من مجموعة فوسفات ترتبط بسكر الريبوز أو ريبوز منقوص الأكسجين والذي يرتبط بقاعدة نيتروجينية. تعد الأحماض النووية هامة لتخزين واستعمال المعلومات الوراثية، وترجمتها عبر عمليات النسخ، والاصطناع الحيوي للبروتين. تتم حماية هذه المعلومات بواسطة آليات ترميم الدنا وتنتشر بواسطة تضاعف الحمض النووي الريبوزي منقوص الأكسجين. تمتلك العديد من الفيروسات جينوم من الحمض النووي الريبوزي، مثل فيروس العوز المناعي البشري، الذي يستخدم الانتساخ العكسي لصنع نموذج DNA من جينوم الـRNA. الـRNA في إنزيمات الحمض النووي الريبوزي مثل جسيمات التضفير والريبوسومات تشبه الإنزيمات في قدرتها على تحفيز التفاعلات الكيميائية. يتم تكوين النيوكليوسيدات عن طريق ارتباط قاعدة نووية بسكر ريبوز. تلك القواعد هي عبارة عن مركبات حلقية غير متجانسة تحتوي على النيتروجين، وتصنف إما بيورينات أو بيريميدينات. تعمل النوكليوتيدات كعوامل مرافقة في تفاعلات الأيض.
العوامل المرافقة

تركيب أسيتيل مرافق الإنزيم-أ مجموعة الأسيتيل المتنقلة ترتبط بذرة الكبريت في أقصى اليسار.
يتضمن الأيض مجموعة شاسعة من التفاعلات الكيميائية، لكن أغلبها يقع تحت أنواع أساسية قليلة من التفاعلات التي تتضمن انتقال مجموعات وظيفية من الذرات وروابطها بين الجزيئات. تسمح الكيمياء المشتركة للخلايا باستخدام مجموعة صغيرة من الوسائط الأيضية لحمل المجموعات الكيميائية بين التفاعلات المختلفة. تلك الوسائط الناقلة للمجموعات تسمى عوامل مرافقة. يتم تنفيذ كل فئة من التفاعلات الناقلة للمجموعات بواسطة عامل مرافق معين، وهو ركيزة لمجموعة من الإنزيمات التي تنتجه، ومجموعة من الإنزيمات التي تستهلكه. لذلك يتم تصنيع واستهلاك وإعادة تدوير تلك العوامل المرافقة باستمرار.
عامل مرافق مركزي هو أدينوسين ثلاثي الفوسفات (ATP)، العملة الموحدة للطاقة في الخلايا. يستخدم هذا النوكليوتيد لتقل الطاقة الكيميائية بين التفاعلات الكيميائية المختلفة. توجد كمية قليلة من ATP في الخلايا، ولكن تتم إعادة توليده باستمرار، يمكن أن يستخدم الجسم البشري وزنه من الـATP في اليوم. يعمل أدينوسين ثلاثي الفوسفات كجسر بين التقويض والابتناء. يقوم التقويض بتكسير الجزيئات، ويضعهم الابتناء معًا. تولد تفاعلات التقويض ATP، فيما تستهلكه تفاعلات الابتناء. كما يعمل أيضا كحامل لمجموعات الفوسفات في تفاعلات الفسفرة.
الفيتامين هو مركب عضوي يحتاجه الجسم بكميات صغيرة ولا يمكن تصنيعه في الخلايا. في تغذية الإنسان، تعمل أغلب الفيتامنيات كعوامل مرافقة بعد التعديل، على سبيل المثال، كل الفيتامينات التي تذوب في الماء تنم فسفرتها أو ترتبط بالنوكليوتيدات حين يتم استخدامها في الخلايا.ثنائي نوكليوتيد الأدنين وأميد النيكوتين (NAD+)، أحد مشتقات فيتامين ب3 (نياسين)، يعد عامل مرافق مهم يعمل كمستقبل للهيدروجين. تقوم مئات الأنواع المنفصلة من الإنزيمات نازعة الهيدروجين بنزع الإلكترونات من ركائزها وتختزل NAD+ إلى NADH. تلك الصورة المختزلة من العامل المرافق تصبح ركيزة للعديد من الإنزيمات المختزلة في الخلية.
يتواجد
ثنائي نوكليوتيد الأدنين وأميد النيكوتين في شكلين مرتبطين في الخلية، NADH
وNADPH. الشكل الأول NAD+/NADH هو أكثر
أهمية في تفاعلات التقويض، بينما يستخدم NADP+/NADPH في تفاعلات الابتناء.
تركيب الهيموغلوبين. وحدات البروتين بالأحمر والأزرق، والمجموعات التي تحتوي على الهيم بالأخضر. من ببب: 1GZX.
المعادن والعوامل المرافقةتلعب العناصر غير العضوية أدوارًا هامة في الأيض، بعضها وفير (مثل الصوديوم، والبوتاسيوم) فيما يؤدي البعض الآخر وظائفه في تركيزات دقيقة. تتكون حوالي 99% من كتلة الثدييات من العناصر التالية: كربون، ونيتروجين، وكالسيوم، وكلور، وبوتاسيوم، وهيدروجين، وفوسفور، وأكسجين، وكبريت.
تحتوي المركبات العضوية (البروتينات، والدهون، والسكريات) على أغلب الكربون والنيتروجين، يتواجد أغلب الأكسجين والهيدروجين في صورة ماء.
تعمل العناصر غير العضوية الوفيرة ككهارل أيونية. الأيونات الأكثر أهمية هي الصوديوم، والبوتاسيوم، والكالسيوم، والماغنسيوم، والكلور، والفوسفات، والأيون العضوي بيكربونات. المحافظة على تدرج أيوني دقيق عبر الأغشية الخلوية يحافظ على الضغط الإسموزي والأس الهيدروجيني. الأيونات مهمة كذلك لوظيفة الأعصاب والعضلات، حيث يتم إنتاج جهد الفعل في تلك الأنسجة بواسطة تبادل الكهارل بين السائل خارج خلوي وسائل الخلية (عصارة خلوية). تدخل الكهارل الخلايا وتغادرها عبر بروتينات في غشاء الخلية تسمى قنوات أيونية. على سبيل المثال، يعتمد الانقباض العضلي على حركة الكالسيوم، والصوديوم، والبوتاسيوم عبر القنوات الأيونية في غشاء الخلية والأنيبيبات المستعرضة.توجد الفلزات الانتقالية عادة في صورة عناصر شحيحة في الكائنات، ويعد الحديد والزنك الأكثر وفرة. تستخدم تلك الفلزات في بعض البروتينات كعوامل مرافقة وهي ضرورية لنشاط إنزيمات مثل كاتالاز والبروتينات الحاملة للأكسجين مثل الهيموغلوبين.
التفاعلات
تنقسم تفاعلات الاستقلاب إلى:
1- تفاعلات الهدم Catabolism: حيث يتم تكسير المواد الغذائية الرئيسية سواء كانت كربوهيدرات أو بروتينات أو دهون خلال طرق مختلفة من التفاعلات الحيوية إلى جزيئات بسيطة وينتج عن ذلك الحصول على الطاقة.
2-تفاعلات البناء (Anabolism): الجزيئات البسيطة الناتجة من عملية الهدم يمكن استخدامها كنواة لبناء مواد أكثر تعقيداً سواء كانت بروتينية أو أحماض نووية من خلال سلسلة من التفاعلات وذلك لبناء الأنسجة وتستهلك طاقة في تلك التفاعلات.
تأخذ عمليات البناء والهدم مسارات مختلفة من ناحية التفاعلات الحيوية داخل جسم الكائن الحي، يتم فيها تحويل المواد الكيميائية عن طريق سلسلة من الأنزيمات.هذه الأنزيمات هي حاسمة لعملية التمثيل الغذائي حيث تعمل على تسريع التفاعلات وتكون مهمة جداً في الحفاظ على حياة الخلية.
أحد السمات البارزة في عملية الأيض هو التشابه في المسارات الأساسية بين كائنات تختلف اختلافاً شاسعاً عن بعضها البعض.
معظم الهياكل التي تشكل الحيوانات والنباتات والميكروبات مصنوعة من ثلاث فئات أساسية من الجزيئات: الأحماض الأمينية، الكربوهيدرات، والدهون. ووظيفة التمثيل الغذائي تتركز في استخدام هذه الجزيئات في بناء الخلايا والأنسجة، أو تقسيمها واستخدامها كمصدر للطاقة. ويمكن أن تجتمع هذه المواد الكيميائية لتشكل بوليمرات مثل الحمض النووي والبروتينات.
ويبدأ استقلاب الكربوهيدرات مع امتصاص الغلوكوز عبر جدران الأمعاء إلى الدم فيحمل البعض منه إلى مختلف أنحاء الجسم حيث يتم استقلابه في حين يتم تخزين البعض الآخر في الكبد والعضلات على شكل سكر أو غلايكوجين وتتفكك بعد ذلك عند الحاجة.
التقويضالتقويض هو مجموعة من العمليات الأيضية التي تقوم بتكسير الجزيئات الكبيرة. تشمل تلك التفاعلات تكسير وأكسدة جزيئات الطعام. الهدف من تفاعلات التقويض هو توفير الطاقة والمكونات المطلوبة في تفاعلات الابتناء التي تبني الجزيئات. تختلف طبيعة تلك التفاعلات من كائن لآخر، ويمكن تقسيم الكائنات وفقًا لمصادر الطاقة والكربون الخاصة بهم (مجموعات غذائية أساسية)، كما يتضح في الجدول بالأسفل. تستخدم الجزيئات العضوية كمصدر للطاقة بواسطة الكائنات عضوية التغذية، فيما تستخدم الكائنات جمادية التغذية ركائز غير عضوية، وتستخدم الكائنات ضوئية التغذية ضوء الشمس كطاقة كيميائية. على أي حال، تعتمد كل تلك الأشكال المختلفة من الأيض على تفاعلات أكسدة-اختزال تتضمن انتقال إلكترونات من متبرع مختزَل مثل المركبات العضوية، أو الماء، أو الأمونياك، أو كبريتيد الهيدروجين، أو حديدوز إلى جزيئات مستقبلة مثل الأكسجين، أو النترات، أو الكبريتات. في الحيوانات، تتضمن تلك التفاعلات مركبات عضوية معقدة يتم تكسيرها إلى جزيئات أبسط، مثل ثنائي أكسيد الكربون والماء. في كائنات البناء الضوئي، مثل النباتات والبكتيريا الزرقاء، لا تُطلق تلك التفاعلات الناقلة للإلكترونات طاقة وإنما تستعمل كطريقة لتخزين الطاقة الممتصة من ضوء الشمس.
تصنيف الكائنات وفقا لأيضهم مصدر الطاقة ضوء الشمس ضوئية- -التغذية
الجزيئات المشكلة سابقا كيميائية-
المتبرع بالإلكترون مركبات عضوية عضوية-
مركبات لاعضوية جمادية-
مصدر الكربون مركبات عضوية غيري-
مركبات لاعضوية ذاتية-
يمكن فصل المجموعة الأكثر شيوعًا من تفاعلات التقويض في الحيوانات إلى 3 مراحل رئيسية. في المرحلة الأولى، يتم هضم مركبات عضوية كبيرة، مثل البروتينات، أو متعددات السكاريد، أو الدهون إلى مكوناتهم الأصغر خارج الخلايا. المرحلة التالية، يتم استيعاب تلك الجزيئات الأصغر بواسطة الخلايا وتحويلها لجزيئات أصغر، عادة أسيتيل مرافق الإنزيم-أ، الذي يطلق بعض الطاقة. أخيرا، مجموعة الأسيتيل الموجودة في أسيتيل مرافق الإنزيم-أ يتم أكسدتها إلى ماء وثنائي أكسيد الكربون في دورة حمض الستريك وسلسلة نقل الإلكترون، ما يحرر طاقة يتم تخزينها عن طريق اختزال العامل المرافق ثنائي نوكليوتيد الأدنين وأميد النيكوتين (NAD+) إلى NADH.
الهضم
الجزيئات الضخمة مثل النشا، أو السليولوز، أو البروتينات لا يمكن استيعابها بسرعة بواسطة الخلايا ويجب تكسيرها لوحدات أصغر قبل استخدامها في أيض الخلية. العديد من فئنات الإنزيمات المشتركة تهضم تلك البوليمرات. تلك الإنزيمات الهضمية تشمل ببتيداز الذي يهضم البروتينات إلى أحماض أمينية، بالإضافة إلى هيدروليزات الغلايكوسيد التي تهضم متعددات السكاريد إلى سكريات بسيطة تعرف باسم سكر أحادي.
تفرز الميكروبات ببساطة إنزيمات هضمية إلى البيئة المحيطة بها، بينما تستطيع الحيوانات إفراز تلك الإنزيمات فقط من خلايا متخصصة في قناتها الهضمية التي تشمل الغدد اللعابية، والمعدة، والبنكرياس. الأحماض الأمينية، أو السكريات الناتجة عن تلك الإنزيمات يتم ضخها لداخل الخلايا بواسطة بروتينات النقل النشط.
الطاقة
من المركبات العضوية
مخطط مبسط للمرحلة الأولى لفك البروتينات، والسكريات، والدهون (ينتج Acetyl-CoA).
تقويض السكريات هو تكسير السكريات إلى وحدات أصغر. عادة ما يتم استيعاب السكريات لداخل الخلايا بمجرد أن يتم هضمها إلى سكريات أحادية. بمجرد دخولها، الطريقة الأكبر للتحلل هي تحلل الجلوكوز، والتي يتم فيها تحويل سكريات مثل الجلوكوز والفركتوز إلى حمض البيروفيك مع توليد بعض جزيئات أدينوسين ثلاثي الفوسفات (ATP).
حمض البيروفيك هو مركب وسيط في العديد من المسارات الأيضية، لكن أغلبه يتم تحويله إلى أسيتيل مرافق الإنزيم-أ عن طريق تحلل الجلوكوز الهوائي ويتم تقديمه لدورة حمض السيتريك. رغم أنه يتم توليد المزيد من ATP في دورة حمض الستريك، فإن المنتج الأهم هو NADH الذي يتم تصنيعه من NAD+ عند أكسدة أسيتيل مرافق الإنزيم-أ. تحرر الأكسدة ثنائي أكسيد الكربون كمخلف للتفاعل. في الظروف اللاهوائية، يُنتج تحلل الجلوكوز حمض اللبنيك، عن طريق قيام إنزيم نازع لهيدروجين اللاكتات بإعادة أكسدة NADH إلى NAD+ ليتم استخدامه مجددا في تحلل الجلوكوز. طريق بديل لتكسير الجلوكوز هو مسار فوسفات البنتوز، الذي يختزل العامل المرافق فوسفات ثنائي نيوكليوتيد الأدينين وأميد النيكوتين NADPH وينتج سكريات خماسية مثل الريبوز.
يتم تقويض الدهون عن طريق التحلل المائي إلى أحماض دهنية حرة وغليسرول. يدخل الغليسرول في مسار تحلل الجلوكوز بينما يتم تكسير الأحماض الدهنية بواسطة أكسدة الحمض الدهني لتحرير أسيتيل مرافق الإنزيم-أ، الذي يتم تقديمه لدورة حمض الستريك. تطلق الأحماض الدهنية طاقة أكبر من السكريات عند أكسدتها لأن السكريات تحتوي على أكسجين أكثر في تركيبها. يتم تحليل الستيرويدات أيضا في بعض البكتيريا في عملية مشابهة لأكسدة الحمض الدهني، وتشمل عملية التحلل تلك إطلاق كميات كبيرة من أسيتيل مرافق الإنزيم-أ، وبروبيونيل مرافق الإنزيم-أ، وحمض البيروفيك، والذين يمكن استخدامهم جميعا بواسطة الخلية كمصدر للطاقة. بكتيريا المتفطرة السلية يمكنها أن تنمو اعتمادا على الكولسترول كمصدر وحيد للكربون، وتم التحقق من صحة أن الجينات المشاركة في مسارات استهلاك الكولسترول مهمة خلال مراحل متنوعة من دورة حياة العدوى لبكتيريا المتفطرة السلية.يتم استخدام الأحماض الأمينية إما لتصنيع البروتينات والجزيئات الحيوية الأخرى، وإما كمصدر للطاقة عن طريق أكسدتها إلى يوريا وثنائي أكسيد الكربون. يبدأ مسار الأكسدة بنزع مجموعة الأمين عن طريق ناقلة الأمين. يتم تقديم مجموعة الأمين لدورة اليوريا، ما يترك هيكل كربوني منزوع الكربون في صورة حمض كيتو. العديد من أحماض الكيتو تلك تعد مركبات وسيطة في دورة حمض الستريك، على سبيل المثال نزع الأمين من حمض الجلوتاميك يكوِّن حمض ألفا كيتوجلوتاريك. يمكن كذلك تحويل الأحماض الأمينية المنتجة للجلوكوز إلى جلوكوز، من خلال استحداث الجلوكوز.
تحويل الطاقة
فسفرة تأكسديةفي الفسفرة التأكسدية، يتم إزالة الإلكترونات من الجزيئات العضوية في مناطق مثل دورة حمض البروتاغون ويتم تحويلها لأكسجين وتستخدم الطاقة المتحررة في تصنيع أدينوسين ثلاثي الفوسفات (ATP). يتم ذلك في حقيقيات النوى بواسطة سلسلة من البروتينات في أغشية الميتوكوندريا تعرف باسم سلسلة نقل الإلكترون. في بدائيات النوى، توجد تلك البروتينات في الغشاء الداخلي للخلية. تستخدم تلك البروتينات الطاقة المتحررة من الالكترونات المارة عبر الجزيئات المختزلة مثل NADH لضخ البروتونات عبر الغشاء.💥
آلية أيه تي بي سينثاز. يظهر ATP باللون الأحمر، و ADP ،و الفوسفات باللون الوردي والوحدة الدوارة الدورية باللون الأسود.
ضخ البروتونات خارج الميتوكندريا يخلق فرق في تركيز البروتون عبر الغشاء ويولد تدرج كهروكيميائي.
تقود هذه القوة البروتونات مرة أخرى لداخل الميتوكندريا عن طريق قاعدة إنزيم يسمى أيه تي بي سينثاز. يجعل تدفق البروتونات الوحدة الدوارة تدور، ما يغير من شكل الموقع النشط في الإنزيم ويقوم بفسفرة ADP محولا إياه إلى ATP.
طاقة من المركبات غير العضويةجمادي التغذية الكيميائي هو نوع من الأيض يوجد في بدائيات النوى حيث يتم الحصول على الطاقة من أكسدة المركبات غير العضوية. يمكن لتلك المتعضيات استخدام الهيدروجين، أو مركبات الكبريت المختزلة (مثل الكبريتيد، وكبريتيد الهيدروجين، وثيوكبريتات)، أوأكسيد الحديد الثنائي، أو الأمونيا كمصادر لاختزال الطاقة ويحصلون على الطاقة عن طريق أكسدة تلك المركبات بواسطة قابلات الإلكترونات مثل الأكسجين أو النتريت. تلك العمليات الميكروبية مهمة في الدورات الحيوية الجيولوجية الكيميائية العامة مثل تكوين الأسيتون، والنترجة، ونزع النيتروجين وهي عمليات مهمة لخصوبة التربة.
طاقة من الضوءتنتزع النباتات، والبكتيريا الزرقاء، والبكتيريا الأرجوانية، والخضربيات وبعض الطلائعيات الطاقة من ضوء الشمس. ترتبط هذه العملية عادة بتحويل ثنائي أكسيد الكربون إلى مركبات عضوية، كجزء من البناء الضوئي. يمكن مع ذلك أن تتم العمليتان بشكل منفصل كما في بدائيات النوى، كما يمكن للبكتيريا الأرجوانية، والخضربيات استخدام ضوء الشمس كمصدر للطاقة مع التنقل بين تثبيت الكربون أو تخمير المواد العضوية.في العديد من المتعضيات يشبه انتزاع الطاقة الشمسية في المبدأ الفسفرة التأكسدية، حيث يشمل تخزين الطاقة في صورة فرق تركيز لبروتون. ذلك الفرق في التركيز هو الذي يؤدي لتصنع ATP. تأتي الإلكترونات المطلوبة لسلسة نقل الإلكترون من بروتينات جامعة للضوء تسمى رودوبسين أو مراكز رد فعل البناء الضوئي. يتم تقسيم مراكز رد الفعل إلى نوعين على حسب نوع صبغة البناء الضوئي الموجودة، تملك أغلب البكتيريا البانية للضوء نوع واحد، فيما تملك النباتات والبكتيريا الزرقاء نوعين.في النباتات، والطحالب، والبكتيريا الزرقاء، تستخدم وحدات النظام الثاني للبناء الضوئي الطاقة الضوئية لإزالة الإلكترونات من الماء، وتحرير الأكسجين كمخلف للتفاعل. تتدفق الإلكترونات بعد ذلك إلى سيتوكروم b6f complex، الذي يستخدم طاقتهم لضخ البروتونات عبر غشاء الثايلاكويد في البلاستيدات الخضراء. تنتقل تلك البروتونات مرة أخرى عبر الغشاء حيث تدفع أيه تي بي سينثاز -كما سبق-. تتدفق الإلكترونات بعد ذلك عبر وحدات النظام الأول للبناء الضوئي ويمكنها بعد ذلك إما أن تختزل تميم الإنزيم NADP+، لاستخدامه في دورة كالفين، أو أن يعاد تدويرها لتوليد المزيد من ATP.
الابتناء
الابتناء هو مجموعة من العمليات الأيضية البناءة يتم فيها استخدام الطاقة المتحررة من التقويض لتصنيع جزيئات معقدة. عمومًا، يتم تصنيع الجزئيات المعقدة التي تكون التركيب الخلوي خطوة بخطوة من مركبات طليعية صغيرة وبسيطة. يشمل الابتناء 3 مراحل أساسية. أولا، إنتاج المركبات الطيلعية مثل الأحماض الأمينية، والسكر الأحادي، وتربينويد، ونوكليوتيدات، وثانيا، تنشيطهم إلى صور متفاعلة باستخدام الطاقة من أدينوسين ثلاثي الفوسفات، وثالثا، تجميع تلك المركبات الطليعية لتكوين جزيئات معقدة مثل البروتينات، ومتعددات السكاريد، والدهون، والأحماض النووية.
تختلف الكائنات من حيث عدد الجزيئات التي يتم بناؤها في خلاياها. الكائنات ذاتية التغذية مثل النباتات يمكنها بناء الجزيئات العضوية المعقدة في الخلايا مثل متعددات السكاريد والبروتينات من جزيئات بسيطة مثل ثنائي أكسيد الكربون والماء. الكائنات غيرية التغذية في المقابل، تحتاج لمصدر للمواد الأكثر تعقيدا، مثل السكريات الأحادية والأحماض الأمينية، لإنتاج تلك الجزيئات المعقدة. يمكن تصنيف الكائنات بحسب المصدر النهائي للطاقة: تحصل الكائنات ضوئية التغذية، والكائنات الضوئية غيرية التغذية على الطاقة من الضوء، بينما تحصل الكائنات كيميائية التغذية، والكائنات كيميائية غيرية التغذية على الطاقة من تفاعلات أكسدة غير عضوية
تثبيت
الكربون
خلايا نبانية (محاطة بجدران بنفسجية) مليئة بالبلاستيدات الخضراء، وهي موقع البناء الضوئي
البناء الضوئي هو تصنيع الكربوهيدرات من ضوء الشمس وثنائي أكسيد الكربون في النبات، والبكتيريا الزرقاء، والطحالب، البناء الضوئي الأكسجيني يقسم الماء، وينتج الأكسجين كمخلفات للتفاعل. تستخدم هذه العملية أدينوسين ثلاثي الفوسفات (ATP) وثنائي نوكليوتيد الأدنين وأميد النيكوتين (NADPH) الناتجان عن مراكز رد فعل البناء الضوئي لتحويل ثنائي أكسيد الكربون إلى حمض 3-فوسفوغليسيريك، الذي يمكن تحويله بعد ذلك إلى جلوكوز. يتم تنفيذ تفاعل تثبيت الكربون بواسطة إنزيم روبيسكو كجزء من دورة كالفين. يحدث 3 أنواع من البناء الضوئي في النباتات: تمثيل ضوئي ثلاثي الكربون، وتمثيل ضوئي رباعي الكربون، وأيض حامض المخلدات. الفرق بين أولئك هو الطريق الذي يسلكه ثنائي أكسيد الكربون نحو دورة كالفين، ففي ثلاثي الكربون يقوم النبات بتثبيت ثنائي أكسيد الكربون مباشرة، أما في النوعين الآخرين يدمج البناء الضوئي ثنائي أكسيد الكربون في المركبات الأخرى أولا، كطريقة للتكيف مع ضوء الشمس القوي والظروف الجافة.في بدائيات النوى التي تقوم بالبناء الضوئي، آليات تثبيت الكربون أكثر تنوعا. حيث يمكن تثبيت ثنائي أكسيد الكربون بواسطة دورة كالفين، وهي دورة حمض الستريك ولكن معكوسة، أو عن طريق إضافة كربوكسيل لأسيتيل مرافق الإنزيم-أ. بدائيات النوى كيميائية التغذية تثبت ثنائي أكسيد الكربون عبر دورة كالفين، ولكنها تستخدم الطاقة الصادرة من المركبات غير العضوية لتحفيز التفاعل.
السكريات والغليكاناتفي ابتناء السكريات، يمكن تحويل الأحماض العضوية البسيطة إلى سكريات أحادية مثل الجلوكوز ثم تجميعها لتكوين متعددات السكاريد مثل النشا. توليد الجلوكوز من مركبات مثل حمض البيروفيك، وحمض اللبنيك، وغليسرول، وحمض 3-فوسفوغليسيريك، والأحماض الأمينية يسمى استحداث الجلوكوز. يحول استحداث الجلوكوز حمض البيروفيك إلى جلوكوز 6-فوسفات عبر سلسلة من المركبات الوسطية، تشترك العديد منها في تحلل الجلوكوز. على أي حال، هذا المسار ليس مجرد تحلل الجلوكوز بشكل معكوس، حيث أن العديد من الخطوات يتم تحفيزها بإنزيمات غير موجودة في تحلل الجلوكوز. هذا الأمر مهم حيث يسمح بتنظيم تكوين وتكسير الجلوكوز بشكل منفصل، ويمنع حدوث المسارين بالتزامن في حلقة مفرغة.رغم أن الدهون هي طريقة شائعة لتخزين الطاقة، في الفقاريات مثل الإنسان لا يمكن تحويل الأحماض الدهنية في تلك المخازن إلى جلوكوز من خلال استحداث الجلوكوز حيث أن تلك الكائنات لا يمكنها تحويل أسيتيل مرافق الإنزيم-أ إلى حمض البيروفيك، تمتلك النباتات الإنزيمات الضرورية لذلك بينما لا تمتلكها الحيوانات. نتيجة لذلك، بعد فترة طويلة من المجاعة، تحتاج الفقاريات لإنتاج أجسام كيتونية من الأحماض الدهنية لاستبدال الجلوكوز في الأنسجة مثل المخ الذي لا يستطيع أيض الأحماض الدهنية. في الكائنات الأخرى كالنباتات والبكتيريا، يتم حل تلك المشكلة الأيضية باستخدام دورة الجلايكسولات، التي تتجاوز خطوة نزع الكربوكسيل الموجودة في دورة حمض الستريك وتسمح بتحول أسيتيل مرافق الإنزيم-أ إلى حمض أكسالوأسيتيك، الذي يمكن استخدامه لإنتاج الجلوكوز.يتم تصنيع متعددات السكاريد والغليكانات عن طريق إضافة متتابعة للسكريات الأحادية بواسطة إنزيم ناقل الغليكوزيل من سكر-فوسفات تفاعلي متبرع مثل غلوكوز ثنائي فوسفات اليوريدين إلى مجموعة هيدروكسيل مستقبلة على متعدد السكاريد النامي. نظرًا لأن أي من مجموعات الهيدروكسيل على حلقة المادة المتفاعلة يمكن أن تكون مستقبلة، يمكن أن يكون متعدد السكاريد الناتج إما متفرع أو مستقيم. يمكن أن تمتلك متعددات السكاريد الناتجة وظائف تركيبية أو أيضية، أو يتم تحويلها إلى دهون أو بروتينات.
الأحماض
الدهنية، وتربينويد، وستيرويدات 
نسخة مبسطة من مسار تصنيع ستيرويد. تم إزالة بعض المركبات الوسيطة من أجل الوضوح.
يتم تصنيع الأحماض الدهنية بواسطة إنزيم مصنع الحمض الدهني الذي يبلمر ثم يختزل وحدات أسيتيل مرافق الإنزيم-أ. حلقات الأسيل الموجودة في الأحماض الدهنية تتمدد بواسطة حلقة من التفاعلات التي تضيف مجموعة الأسيل، وتختزلها إلى كحول، ثم تنزع منها الماء لتحولها إلى مجموعة ألكين ثم تختزلها مجددا إلى مجموعة ألكان. تنقسم إنزيمات التصنيع الحيوي للأحماض الدهنية إلى مجموعتين: في الحيوانات والفطريات، يتم تنفيد كل تفاعلات تصنيع الحمض الدهني بواسطة بروتين واحد متعدد الوظائف، أما في بلاستيدات النبات وفي البكتيريا يؤدي إنزيم مختلف كل خطوة في المسار.تربين، وتربينويد هما فئة كبيرة من الدهون التي تشمل كاروتينات وتشكل الفئة الأكبر من المنتجات الطبيعية للنبات. يتم تصنيع تلك المركبات عن طريق تجميع وتعديل وحدات إيزوبرين التي تتبرع بها مركبات طليعية متفاعلة. تفاعل مهم يستخدم المركبات المتبرعة بإيزوبرين هو تصنيع الستيرويد. حيث تنضم وحدات إيزوبرين لبعضها لبعض لتكوين سكوالين ثم يتم طيها لتشكيل مجموعة من الحلقات لتكون لانوستيرول. يمكن بعد ذلك تحويل لانوستيرول ‘لى ستيرويدات أخرى مثل كولسترول وإرغوستيرول.
البروتيناتتختلف الكائنات في قدرتها على تصنيع الـ20 حمض أميني المشتركة. تستطيع أغلب البكتيريا والنباتات تصنيع العشرين حمض جميعهم، إلا أن الثدييات تستطيع تصنيع 11 حمض أميني غير ضروري، لذلك فإن 9 أحماض أمينية ضرورية يجب الحصول عليها من الغذاء. بعض الطفيليات البسيطة، مثل بكتيريا المفطورة الرئوية، تفتقد القدرة على تصنيع أي من الأحماض الأمينية وتحصل على أحماضها الأمينية مباشرة من العائل. يتم تصنيع كل الأحماض الأمينية من مركبات وسطية في تحلل الجلوكوز، ودورة حمض الستريك، أو مسار فوسفات البنتوز. يتم توفير النيتروجين بواسطة حمض الجلوتاميك والجلوتامين. يعتمد تصنيع الأحماض الأمينية على تكوين حمض كيتو ألفا المناسب، الذي يتم نقل مجموعة الأمين له لتكوين حمض أميني.يتم تصنيع البروتينات من الأحماض الأمينية عن طريق ضم بعضها لبعض في سلسلة من الروابط الببتيدية. يملك كل بروتين مختلف تسلسل فريد من الأحماض الأمينية: وهذا هو تركيبه الأولي. تماما كما يمكن دمج حروف الأبجدية لتكوين عدد لا نهائي من الكلمات، يمكن ربط الأحماض الأمينية في تسلسلات مختلفة لتكوين عدد هائل من البروتينات. يتم تصنيع البروتينات من الأحماض الأمينية التي تم تنشيطها عن طريق الارتباط بجزئ حمض نووي ريبوزي ناقل برابطة إستر. يتم إنتاج هذا المركب الطليعي في تفاعل يعتمد على أدينوسين ثلاثي الفوسفات. يعد هذا المركب ركيزة للريبوسوم، الذي ينضم إلى الحمض الأميني على سلسلة البروتين المطوي ، باستخدام معلومات التسلسل في الحمض النووي الريبوزي الرسول.
تصنيع وإنقاذ النوكليوتيدتتكون النوكليوتيدات من أحماض أمينية، وثنائي أكسيد الكربون، وحمض الفورميك في مسارات تتطلب كميات كبيرة من الطاقة الأيضية. بناء على ذلك، تمتلك أغلب الكائنات أنظمة فعالة لإنقاذ النوكليوتيدات المتكونة. يتم تصنيع البيورين كنيوكليوسيد (قواعد مرتبطة بالريبوز). كل من الأدينين، والغوانين يتم تصنيعهما من مركب نيوكلوسيد طليعي إينوسين أحادي الفوسفات، الذي يتم تصنيعه باستخدام ذرات من الأحماض الأمينية جلايسين، وجلوتامين، وحمض الأسبارتيك. في المقابل، يتم تصنيع بيريميدين من أوروتيت، الذي يتم تصنيعه من جلوتامين وحمض الأسبارتيك.
الدخيل الحيوي وأيض الأكسدة والاختزالتتعرض كل الكائنات الحية باستمرار إلى مركبات لا يمكنهم استخدامها كغذاء وتكون ضارة إذا تراكمت في الخلايا، حيث لا توجد وظيفة أيضية له. تلك المركبات التي يحتمل أن تكون ضارة تسمى الغريب الحيوي أو الدخيل الحيوي. الدخائل الحيوي مثل الأدوية المصنعة، والسموم الطبيعية، والمضادات الحيوية يتم إزالة سميتها بمجموعة من الإنزيمات الأيضية للغريب الحيوي. في الإنسان، تشمل تلك الإنزيمات مؤكسدات سيتوكروم بي450، وغلوكويورنوسايل ترانسفيراز، وجلوتاثيون أس-ترانسفيراز. يعمل هذا الجهاز من الإنزيمات في 3 مراحل لأكسدة الغريب الحيوي أولاً (المرحلة 1) ثم ربط مجموعات قابلة للذوبان في الماء للجزئ (المرحلة 2). الغريب الحيوي المعدل القابل للذوبان في الماء يمكن بعد ذلك ضخة خارج الخلايا وفي الكائنات متعددة الخلايا يمكن أيضه أكثر من ذلك قبل إخراجه (المرحلة 3). في علم البيئة، تلك التفاعلات مهمة بالأخص في التحلل الحيوي الميكروبي للملوثات والمعالجة الحيوية للأرض الملوثة وتسرب النفط. العديد من تلك التفاعلات الميكروبية تتواجد في كائنات متعددة الخلايا، ولكن بسبب التنوع الكبير في أنواع الميكروبات فإن تلك الكائنات قدرة على التعامل مع نطاق أوسع بكثير من الدخائل الحيوية مقارنة بالكائنات متعددة الخلايا، ويمكنها حتى تحليل الملوثات العضوية الثابتة مثل مركبات الكلوريد العضوي.مشكلة متعلقةبالكائنات الهوائية هي الإجهاد التأكسدي. هنا، العمليات التي تشملفسفرة تأكسدية وتكوين روابط ثنائية الكبريتيد خلال تطوي البروتين تنتج أنواع الأكسجين التفاعلية مثل بيروكسيد الهيدروجين. تلك المؤكسدات الضارة تتم إزالتها بواسطة مستقلبات مضادة للتأكسد مثل جلوتاثيون وإنزيمات مثل كاتالاز وبيروكسيداز.
الديناميكا الحرارية للكائنات الحيةيجب أن تخضع الكائنات الحية لقوانين الديناميكا الحرارية، التي تصف انتقال الحرارة والشغل. ينص قانون الديناميكا الحراري الثاني على أنه في أي نظام مغلق، لا يمكن أن تقل كمية الإنتروبيا. رغم أن التعقيد المدهش للكائنات الحية يبدو أنه يتعارض مع هذا القانون، فإن الحياة ممكنة لأن جميع الكائنات تعد نظام مفتوح يتبادل المادة والطاقة مع الأشياء المحيطة به. بالتالي فإن الأنظمة الحية ليست في حالة توازن ترموديناميكي، وإنما هي أنظمة مبددة تحافظ على حالة التعقيد الكبير بالتسبب في زيادة أكبر في الإنتروبيا في بيئاتها. يحقق أيض الخلية ذلك من خلال الربط بين العمليات التلقائية للتقويض والعمليات غير التلقائية للابتناء. بمصطلحات الديناميكا الحرارية، يحافظ الأيض على النظام عن طريق خلق الفوضى.
التنظيم
والتحكمنظرًا لأن بيئة أغلب الكائنات تتغير باستمرار، يجب أن يتم تنظيم تفاعلات
الأيض بشكل دقيق للحفاظ على مجموعة ثابتة من الظروف داخل الخلايا، فيما يعرف باسم
الاستتباب. يسمح تنظيم الأيض كذلك للكائنات الحية بالاستجابة للإشارات والتفاعل
بشكل نشط مع بيئاتهم. مبدآن مترابطان بشكل كبير مهمان للغاية في فهم كيفية التحكم
في المسارات الأيضية. الأول، أن تنظيم إنزيم ما في مسار ما هو كيف أن نشاطه يزيد
ويقل استجابة لإشارات. الثاني، أن التحكم الذي يبذله ذلك الإنزيم هو تأثير تلك
التغيرات في نشاطه على المعدل الكلي للمسار. على سبيل المثال، قد يُظهر إنزيم ما
تغيرات كبيرة في نشاطه (أي أنه منظم بشكل كبير) لكن إذا كانت تلك التغيرات لها أثر
بسيط على معدل المسار الأيضي، فإن هذا الإنزيم ليس مساهما في التحكم في ذلك المسار.
تأثير الانسولين على استيعاب وأيض الجلوكوز. يرتبط الإنسولين بالمستقبل الخاص به (1)، والذي بدوره يبدأ العديد من تتاليات تنشيط البروتين (2). يشمل ذلك: نقل ناقل الجلوكوز 4 إلى الغشاء الخلوي ودخول الجلوكوز (3)، وتصنيع الغلايكوجين (4)، وتحلل الجلوكوز (5) وتصنيع الأحماض الدهنية (6).
توجد العديد من مستويات تنظيم الأيض. في التنظيم الداخلي، يقوم المسار الأيضي بتنظيم نفسه ليستجيب للتغيرات في مستويات الركائز أو المنتجات، على سبيل المثال، نقص كمية المادة المنتجة يزيد التدفق عبر المسار من أجل التعويض. يتضمن هذا النوع من التنظيم عادة تنظيم تفارغي لنشاطات العديد من الإنزيمات في المسار. يتضمن التحكم الخارجي في كائن متعدد الخلايا أن تقوم خلية بتعيير أيضها استجابة لإشارات من خلايا أخرى. تلك الإشارات عادة تكون في صورة رسل ذائبة مثل الهرمونات وعوامل النمو ويتم اكتشفها بواسطة مستقبلات على سطح الخلية. يتم بعد ذلك بث تلك الإشارات داخل الخلية بواسطة أنظمة الرسول الثاني التي تشارك غالبا في فسفرة البروتينات.نموذج مفهوم جدا للتحكم الخارجي هو تنظيم أيض الجلوكوز بواسطة هرمون الإنسولين. يتم إنتاج الإنسولين استجابة لارتفاع سكر الدم. ارتباط الهرمون بمستقبلة الإنسولين على الخلايا ينشط سلسة من البروتين كيناز التي تؤدي لاستيعاب الخلايا للجلوكوز من الدم وتحويله إلى جزيئات تخزين مثل الأحماض الدهنية والغلايكوجين. يتم التحكم في أيض الغلايكوجين عبر نشاط إنزيم فوسفوريلاز، وهو الإنزيم الذي يكسر الغلايكوجين، وغلايكوجين سينثاز، الإنزيم الذي يصنعه. يتم تنظيم تلك الإنزيمات بشكل متبادل، حيث تثبط الفسفرة غلايكوجين سينثاز، وتنشط فوسفوريلاز. يتسبب الإنسولين في تصنيع الغلايكوجين عن طريق تنشيط فوسفاتاز البروتين والتسبب في نقص فسفرة تلك الإنزيمات.
التطور
شجرة تطور تظهر الأصل المشترك للكائنات الحية من النطاقات الثلاثة. البكتيريا ملونة بالأزرق، وحقيقيات النوى بالأحمر، والبكتيريا القديمة بالأخضر. المواقف النسبية لبعض الشعب المدرجة تظهر حول الشجرة.
المسارات المركزية للأيض المذكورة سابقًا، مثل تحلل الجلوكوز، ودورة حمض الستريك، تتواجد في النطاقات الثلاثة للكائنات الحية وكانت متواجدة كذلك في السلف الشامل الأخير. كانت خلية السلف الشامل بدائية النوى ومولدة للميثان غالبا وبها الكثير من أيض الحمض الأميني، والنوكوليوتيد، والسكريات، والدهون. قد يكون الإبقاء على هذه المسارات القديمة خلال التطور المتأخر ناتجا عن أن هذه التفاعلات كانت الحل الأمثل لمشاكلهم الأيضية الخاصة، مع مسارات مثل تحلل الجلوكوز ودورة حمض الستريك تنتج نواتجها النهائية بفعالية عالية وبعدد محدود من الخطوات. قد تكون المسارات الأولى في الأيض القائم على الإنزيمات جزءًا من أيض نوكليوتيد البيورين، فيما كانت مسارات الأيض السابقة جزءًا منفرضية عالم الحمض النووي الريبوزي القديمة.تم اقتراح العديد من النماذج لوصف آليات تطور مسارات الأيض الحديثة. تشمل تلك النماذج إضافات متتابعة لإنزيمات جديدة لمسارات قديمة قصيرة، وتضاعف ثم تشعب المسارات بالكامل بالإضافة لتوظيف الانزيمات الموجودة مسبقا وتجميعها في مسار تفاعل جديد. الأهمية النسبية لتلك الآليات غير واضحة، إلا أن دراسات جينومية أظهرت أن الإنزيمات في مسار ما من المحتمل أن يكون لها سلف مشترك، ما يقترح أن العديد من المسارات قد تطورت خطوة بخطوة مع تكوُّن وظائف جديدة من الخطوات الموجودة سابقًا في المسار. نموذج بديل ظهر من دراسات تتبع تطور تركيب البروتيان في شبكة الأيض، اقترح ذلك النموذج أن الإنزيمات يتم توظيفها بشكل واسع، واستعارة إنزيمات لتأدية وظائف مشابهة في مسارات أيضية مختلفة. تؤدي عملية التوظيف تلك إلى تنوع في التطور الإنزيمي. احتمال ثالث هو أن بعض أجزاء الأيض قد تتواجد في «وحدات» يمكن إعادة استخدماها في مسارات مختلفة وتؤدي نفس الوظائف على جزيئات مختلفة.بالإضافة لتطور مسارات أيضية جديدة، يمكن أن يسبب التطور كذلك فقد بعض الوظائف الأيضية. على سبيل المثال، في بعض الديدان فُقدت العمليات الأيضية غير الضرورية للحياة، وعوضًا عنها يمكن استغلال الأحماض الأمينية، والنوكليوتيدات، والسكريات الموجودة مسبقًا في العائل. يمكن ملاحظة أمثلة مشابهة لفقد القدرات الأيضية في كائنات المعايشة الجوانية.
الاستقصاء
والمعالجة 
شبكة أيض لدورة حمض الستريك فيرشاد أذن الفأر. تظهر الإنزيمات والمستقلبات في صورة مربعات حمراء والتفاعلات بينهما كخطوط سوداء.
بشكل تقليدي، تتم دراسة الأيض بمقاربة اختزالية تركز على مسار أيضي واحد. استعمال القائفات المشعة مفيد بشكل خاص في تعقب الكائن بالكامل، وعلى مستوى النسيج، والخلية، والذي يحدد المسار من المركب الطليعي حتى الناتج النهائي عن طريق التعرف على الوسائط والمنتجات المعلمة بمادة مشعة. الإنزيمات التي تحفز تلك التفاعلات الكيميائية يمكن بعد ذلك تنقيتها ودراسة حركياتها واستجابتها للمثبطات. مقاربة موازية هي التعرف على الجزئيات الصغيرة في خلية أو نسيج، المجموعة الكاملة من تلك الجزيئات تسمى ميتابولوم. بشكل عام، تعطي تلك الدراسات نظرة جيدة على تركيب ووظيفة المسارات الأيضية البسيطة، لكنها غير كافية عند تطبيقها على أنظمة أكثر تعقيدا مثل أيض خلية كاملة.يمكن الحصول على فكرة عن مدى تعقيد شبكات الأيض في الخلايا التي تحتوي على آلاف الإنزيمات المختلفة عن طريق الشكل الموضح في الصورة الذي يعرض التفاعلات بين 43 بروتينًا و40 مستقلبًا فقط: توفر تسلسلات الجينومات قوائم تحتوي على ما يصل إلى 45,000 جين. مع ذلك، من الممكن الآن استخدام تلك البيانات الجينومية لإعادة تشكيل شبكات كاملة من التفاعلات الكيميائية الحيوية وإنتاج نماذج رياضية أكثر كلية قد تشرح وتتوقع سلوكياتهم. تلك النماذج قوية بشكل خاص حين تستخدم لدمج بيانات المسار والمستقلب المحصول عليها عبر الطرق التقليدية مثل التعبير الجيني من الدراسات البروتيومية ومصفوفة دي إن إيه الدقيقة. باستخدام تلك الطرق، تم إنتاج نموذج لأيض الإنسان، ما سيساعد في اكتشاف أدوية مستقبلية وأبحاث الكيمياء الحيوية. تستخدم تلك النماذج الآن في تحليل الشبكات، لتصنيف أمراض الإنسان في مجموعات تتشارك في بروتينات أو مستقلبات مشتركة.تعد شبكات الأيض البكتيرية مثالا صارخًا على تنظيم ربطة العنق على شكل قوس،
وهو تركيب قادر على إدخال نطاق واسع من المغذيات وإنتاج مجموعة كبيرة من المنتجات والجزيئات الكبيرة المعقدة باستخدام تداولات وسيطة مشتركة قليلة نسبيًا.
تطبيق تكنولوجي كبير لتلك المعلومات هو الهندسة الأيضية. وفيها يتم تعديل بعض الكائنات كالخميرة، أو النباتات، أو البكتيريا جينيًا لجعلهم أكثر فائدة في التكنولوجيا الحيوية وللمساعدة في إنتاج أدوية مثل المضادات الحيوية أو الكيماويات الصناعية مثل حمض الشيكيميك. تهدف تلك التعديلات الجينية عادة لتقليل كم الطاقة المستخدم لإنتاج المنتج، وزيادة الإنتاجية، وتقليل مخلفات الإنتاج.
التاريخ
الأيض لأرسطو كنموذج تدفق مفتوح
يحتوي كتاب أجزاء الحيوان لأرسطو على تفاصيل كافية عن وجهة نظره بشأن الأيض تكفي لصنع نموذج تدفق مفتوح. حيث آمن أن كل مرحلة من العملية، يتم فيها تحويل مواد من الطعام، مع إطلاق حرارة باعتباره العنصر التقليدي للحريق، وفضلات يتم إخراجها في صورة بول، أو براز، أو صفراء.وصف ابن النفيس الأيض في عام 1260 في روايته الرسالة الكاملية في السيرة النبوية والتي احتوت عبارة «كل من الجسم وأجزاءه في حالة مستمرة من الانحلال والبناء، لذلك هي حتما تمر بتغيير دائم.» يمتد تاريخ الدراسة العلمية للتمثيل الغذائي لعدة قرون وانتقل من دراسة الحيوانات بالكامل في الدراسات المبكرة، لدراسة التفاعلات الأيضية المفردة في الكيمياء الحيوية الحديثة. تم نشر التجارب المخططة الأولى لأيض الإنسان في 1614 بواسطة سانتوريو سانتوري في كتابه حرق الطب الساكن.
وصف فيه كيف وزن نفسه قبل وبعد الأكل، والنوم، والعمل، وممارسة الجنس، والصوم، والشرب، والإخراج. حيث وجد أن أغلب الطعام الذي تناوله قد فقد عبر ما أسماه «عرق غير ملموس».

سانتوريو سانتوري في ميزانه القباني، من كتاب حرق الطب الساكن، نشر أول مرة في 1614
في تلك الدراسات المبكرة، لم يتم التعرف على آليات تلك العمليات الأيضية وكان من المعتقد أن هناك قوة حيوية تنشط الأنسجة الحية. في القرن الـ19، عند دراسة تخمير السكر إلى كحول بواسطة الخميرة، استنتج لويس باستور أن التخمير تم تحفيزه بواسطة مواد في خلايا الخميرة أسماها «مخمرات». كتب أن «التخمير الكحولي هو عمل مرتبط بحياة وتنظيم خلايا الخميرة، وليس مع موت أو تعفن الخلايا.» هذا الاكتشاف، إلى جانب ما نشره فريدرش فولر في 1828 عن بحث حول التصنيع الكيميائي لليوريا،
وكونها أول مركب عضوي يحضر بالكامل من مركبات طليعية غير عضوية أثبتا أن المركبات العضوية والتفاعلات الكيميائية الموجودة في الخلية لا تختلف من حيث المبدأ عن أي جزء من الكيمياء.
كان اكتشاف الإنزيمات في بدايات القرن الـ20 بواسطة إدوارد بوخنر هو ما فصل دراسة تفاعلات الأيض الكيميائية عن الدراسة البيولوجية للخلايا، وأشار ببدء الكيمياء الحيوية. نما حجم المعرفة الكيميائية الحيوية بسرعة خلال أوائل القرن الـ20. أحد أكثر علماء الكيمياء الحيوية الجدد المثمرين وقتها كان هانس كريبس الذي قدم إسهامات هائلة في دراسة الأيض. اكتشف كريبس دورة اليوريا ولاحقًا، بالتعاون مع هانز كورنبيرج، دورة حمض الستريك ودورة الجلايكسولات.
تمت مساعدة أبحاث الكيمياء الحيوية الحديثة بشكل كبير بسبب تطور التقنيات الحديثة مثل الاستشراب، ودراسة البلورات بالأشعة السينية، ومطيافية الرنين المغناطيسي النووي، والوسم النظيري، والمجهر الإلكتروني. سمحت تلك التقنيات باكتشاف والتحليل المفصل للعديد من الجزيئات والمسارات الأيضية في الخلايا.
انظر أيضًابروتين دهني منخفض الكثافة
بروتين دهني مرتفع الكثافة
كوليسترول
أيض مفرط
بيروفات سينثاز
أيض الحمض العصاري
أيض فيضي
أيض جرياني
معدل الأيض الأساسي
متلازمة إعادة التغذية
خطأ أيضي خلقي
سلسلة تنفس
تاريخ علم الكيمياء الحيوية
نظرية الجذور الحرة والتشيخ
مرونة الأيض


ليست هناك تعليقات:
إرسال تعليق